
科目: 来源: 题型:
【题目】氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CO(g)+3H2(g) ΔH=+206.2 kJ·mol1。
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH= _______kJ·mol1。
CO2(g)+4H2(g) ΔH= _______kJ·mol1。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。
2NH3(g) ΔH=92.4 kJ·mol1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______(填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________(填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L1·min1,H2的平衡转化率为_______(保留三位有效数字),则该温度下反应的平衡常数K=_______。
(3)下图所示装置工作时均与H2有关。
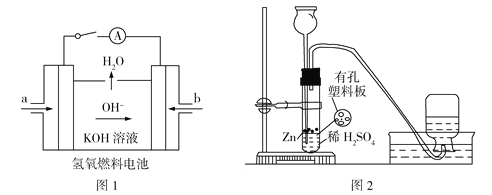
①图l所示装置,通入H2的管口是______(填字母),正极反应式为___________________。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____;Ti原子核外共有________种运动状态不同的电子。
(2)BH3分子与NH3分子的空间结构分别为_________;BH3与NH3反应生成的BH3·NH3分子中含有的化学键类型有_______,在BH3·NH3中B原子的杂化方式为________。
(3)N和P同主族。科学家目前合成了N4分子,该分子中N—N—N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途___________。(写出一种即可)
(4)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是____。
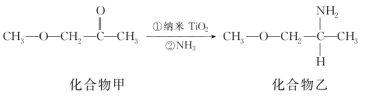
(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲,主要原因是______。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-![]() I2+I-
I2+I-
B.Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至5
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至5
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1×10-4 mol/L的AgNO3溶液滴入到浓度均为1×10-4 mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积不一定等于10-14
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是
A.不考虑空间异构,C2H6O的一氯代物有3种结构
B.分子式符合C5H11Cl的化合物有6种
C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目多于3种
D.菲的结构简式为![]() ,它与硝酸反应可生成6种一硝基取代物
,它与硝酸反应可生成6种一硝基取代物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:溴苯的熔点为30.8℃,沸点156℃。实验室用苯和液溴制取溴苯的装置如图:
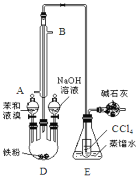
(1)冷凝管的作用___。
(2)E中小试管内CCl4作用___。
(3)用实验证明制取溴苯的反应是取代反应还需添加的试剂是___。
(4)写出图中装有碱石灰的仪器的名称___。
(5)苯与溴还可能发生副反应生成对二溴苯(沸点220℃)和邻二溴苯(沸点224℃),在实验得到的溴苯中还含有二溴苯,可通过___(填分离方法)提纯得到溴苯,写出生成对二溴苯的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
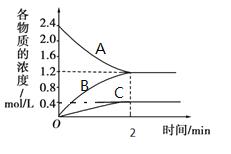
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
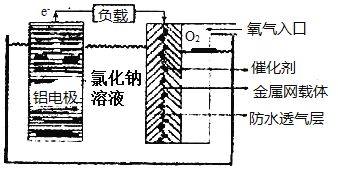
该电池的正极反应方程式为___,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___,相同压强下,AsH3的沸点___NH3(填“大于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是

A.元素非金属性强弱的顺序为W>Y>Z
B.X单质的熔点低于Y单质
C.W分别与X、Y、Z形成的二元化合物均能和水反应
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
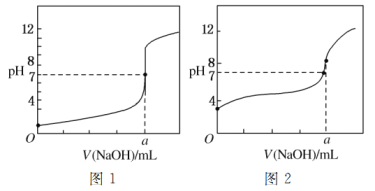
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
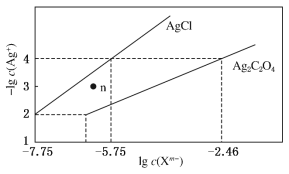
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com