
科目: 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,![]() 气体中所含
气体中所含![]() 数为
数为![]()
B.![]() 的稀
的稀![]() 中,含有
中,含有![]() 数目为
数目为![]()
C.![]() 金属钠与
金属钠与![]() 氧气充分反应,转移的电子数一定为
氧气充分反应,转移的电子数一定为![]()
D.密闭容器中,![]() 和
和![]() 充分反应后分子总数为
充分反应后分子总数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.升高温度能提高活化分子的比例,从而加快反应速率
B.胶体和溶液的本质区别是有无丁达尔效应
C.将![]() 饱和溶液滴入
饱和溶液滴入![]() 溶液中,可获得
溶液中,可获得![]() 胶体
胶体
D.![]() 与
与![]() 都属于酸性氧化物,都能与水反应生成相应的酸
都属于酸性氧化物,都能与水反应生成相应的酸
查看答案和解析>>
科目: 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
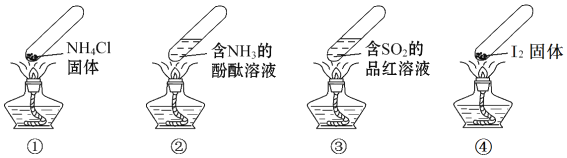
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列叙述中正确的是( )
A.石英是制造光导纤维的原料,也是常用的半导体材料
B.刚玉![]() 硬度仅次于金刚石,可做机械轴承,属于无机非金属材料
硬度仅次于金刚石,可做机械轴承,属于无机非金属材料
C.泰国银饰和土耳其彩瓷,其主要成分均为金属材料
D.手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料
查看答案和解析>>
科目: 来源: 题型:
【题目】为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是( )
A.NH4NO3B.(NH4)2CO3C.NH4ClD.NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )

A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g) + O2(g)![]() TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
Ⅱ.2C(s) + O2(g) ![]() 2CO(g) ΔH =-220.9 kJ/mol
2CO(g) ΔH =-220.9 kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
(2)toC时,向10L恒容密闭容器中充入1mol TiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
① 反应4min末的平均速率v(Cl2)=_____,该温度下K =____(用分数表示),O2的平衡转化率=_______.
② 下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是________
A.缩小容器的体积 B.加入催化剂 C.分离出部分TiO2
D.增加O2的浓度 E.减低温度 F.以上方法均不可以
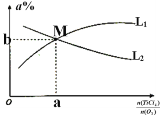
③toC时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图所示:能表示O2的平衡转化率的曲线为_________ (填“L1”或“L2”)M点的坐标为______________(用整数或分数表示)
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
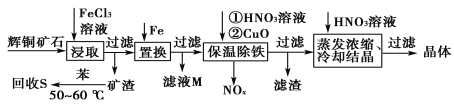
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
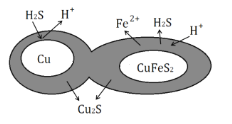
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com