
科目: 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1—xFePO4=6C+LiFePO4。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
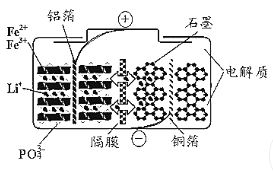
A.放电时Li+脱离石墨,经电解质嵌入正极
B.充电时电子从电源经铝箔流入正极材料
C.隔膜在反应过程中只允许Li+通过
D.充电时电池正极上发生的反应为:LiFePO4-xe-== Li1-xFePO4+xLi+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。

请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______。
(2)产生气体A的离子方程式为____________。
(3)在实验室中收集气体A,可选择如图装置中的______。
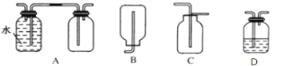
(4)写出④反应中生成溶液H的离子方程式____________。
(5)对不能确定是否存在的离子,请简述检测实验方案__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:___________min(填 “0~1”、“1~2” 、“2~3”“3~4”或“4~5”)。
②从反应开始到3 min末,氢气的平均反应速率v(H2)=______________mol·L-1·min-1
③能够判断该反应达到平衡的是________(填字母) 。
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:__________.
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2![]() + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。
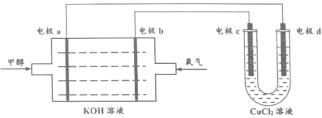
①电极a为电池的_______(填 “正极”或“负极”)
②电极b的电极反应式:________。
③电极C的电极反应式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.Na2S2O3与H2SO4溶液混合产生22.4 L气体时转移电子数为2NA
B.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
C.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目: 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
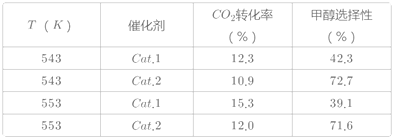
(备注)Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图___。

查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
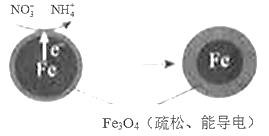
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 23g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数N(O2)的范围为:0.25 NA< N(O2)< 0.5 NA
B. 2 mol NO和1 mol O2在密闭容器中充分反应,反应后容器中的分子数小于2NA
C. 2.5gMg-Zn合金与足量盐酸反应,放出的气体在标况下的体积可能为2.24L
D. 50 mL 18.4 mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )
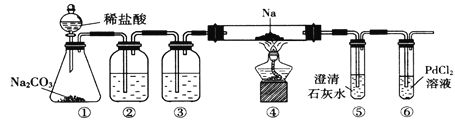
A. 装置①的仪器还可以制取H2气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:

回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com