
科目: 来源: 题型:
【题目】一定温度下,在容积为2 L的密闭容器内, 某一反应中气体M和气体N的物质的量随反应时间变化的曲线如图所示, 请根据图示回答下列问题。
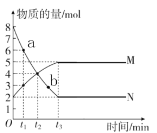
(1)写出该反应的化学方程式:____________。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率为________(用含t1、t3的式子表示)。
(3)比较a点与b点反应速率大小,Va___Vb(填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中,___________(填t1、t2或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是________。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成0.5 mol M
D.容器内压强不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】高聚物![]() 的重要用途之一是生产汽车刹车片,其合成路线如图所示:
的重要用途之一是生产汽车刹车片,其合成路线如图所示:

已知:![]() +
+![]()
![]()
![]()
(1)A→B的反应类型属于_____________,D的名称是_____________,烃F的分子式为____________。
(2)E中含有官能团的名称是___________,C的结构简式为____________。
(3)用文字叙述淀粉转化为A的原理:___________。
(4)写出G→H的化学方程式:__________。
(5)烃F有多种同分异构体,写出其同分异构体中含有2个相同官能团且无支链的链状物质的结构简式:_____(任写三种),其中核磁共振氢谱峰最少的一种物质有______个峰。
(6)写出以2—甲基—1,3—丁二烯和丙烯为原料合成![]() 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以北京大学马丁教授为代表的多个团队,研发出了高效的铁基(如FeC、Fe2C、Fe5C2、Fe3C)费托合成催化剂,以H2和CO为原料可高产率合成烯烃、烷烃,如3CO(g)+ 6H2(g)![]() CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2
CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2![]() CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
(1)Fe3+中能量最高的能级上的电子云有_____种伸展方向,位于不同方向中运动的电子的能量大小关系是_________。当Fe原子电子排布由[Ar]3d64s2→[Ar]3d64s14p1时,体系的能量_______(填“增大”或“减小”)。
(2)Fe、C、O三种元素的第一电离能由大到小的顺序为_____________;CH3CH=CH2分子中碳原子的杂化轨道类型为____,题干所述反应中CO分子中断裂的化学键类型为______(填字母)。
A. 2个σ键、1个π键 B. 1个σ键、2个π键 C. 非极性键
(3)新戊烷[(CH3)4C]分子中5个碳原子形成的空间构型是____________,该分子是________(填“极性”或“非极性”)分子。随着烃分子中碳原子数目的增加,同系物的沸点升高.其原因是__________。
(4)碳铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:

则编号为①的原子的坐标为_______________;该化合物的化学式为_______________,设该晶体的晶胞多数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_______________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱如图:
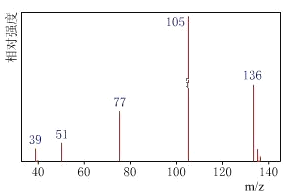
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。
方法三:利用红外光谱仪测得A分子的红外光谱,如图:
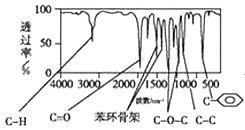
(1)分子中共有____种化学环境不同的氢原子。
(2)A的分子式为____。
(3)该物质属于哪一类有机物____。
(4)A的分子中只含一个甲基的依据是____(填序号)。
a A的相对分子质量 b A的分子式
c A的核磁共振氢谱图 d A分子的红外光谱图
(5)A的结构简式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
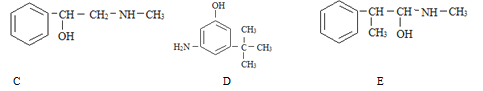
【题目】(1)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经我国科学家研究发现其结构如下图,下列各物质与麻黄素互为同分异构体的是_____(填字母,下同),互为同系物的是_____。
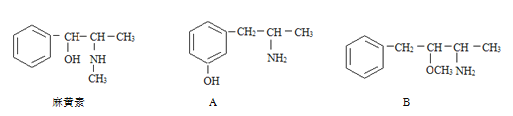
(2)烷基取代苯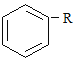 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成 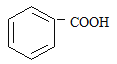 ,但若烷基R中直
,但若烷基R中直
接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到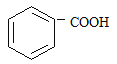 。 现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为的异构体共有7种,其中的3种是
。 现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为的异构体共有7种,其中的3种是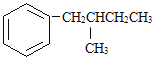
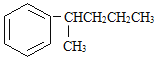
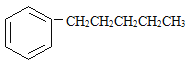
写出另4种的结构简式:
1________ | 2________ |
3________ | 4________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2的资源化利用一直是化学家们关注的重要课题,中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:5CO2(g)+16H2(g)=C5H12(l)+10H2O(l) ΔH=+a kJ/mol (反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知氢气的燃烧热为286 kJ/mol,若要利用H2的燃烧热求a的值,则还需要知道一个反应的ΔH,该反应是___________。反应①在一定条件下具有自发性,则a_____0(填“>”或“<”)。
(2)向某密闭容器中按一定投料比充入 CO2、H2,控制条件使其发生反应:5CO2(g)+16H2(g)![]() C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
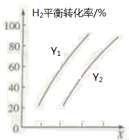
则X表示____________,Y1____________Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是_________(填两种)。
(3)控制一定温度、催化剂,按不同投料比[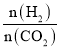 ]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
(4)在钌一铑双金属催化剂的作用下,CH3OH、CO2、H2可高效地转化为乙酸,反应方程式为CH3OH(g)+CO2(g)+H2(g)![]() CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
则反应开始到达平衡的过程中,v(CO2)=________kPa/min,Kp=_______span>kPa-1。
(5)碳捕捉技术的发展也有利于CO2在资源应用方面得到充分利用。常温下,若某次用NaOH溶液捕捉空气中的CO2所得溶液的pH=10,并测得溶液中c(HCO3-)=2c(CO32-),则Ka2(H2CO3)=_______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
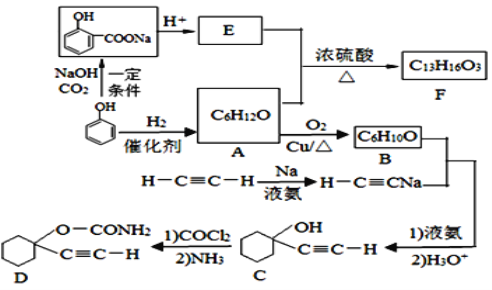
(1)A的化学名称是_____________,C中含氧官能团的名称为_____________。
(2)F的结构简式为____________________,A和E生成F的反应类型为______________。
(3)A生成B的化学方程式为__________________________________________________。
(4)写出由C合成D的第二个反应的化学方程式:_________________________________。
(5)同时满足下列条件的E的同分异构体有_________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。

写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度 [c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不正确的是( )
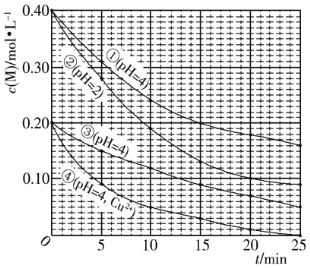
A.水样的PH越小,M的分解速率越快
B.水样中添加Cu2+,能加快M的分解速率
C.由②③得,反应物浓度越大,M的分解速率越快
D.在0~20min内,②中M的平均分解速率为0.015mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com