
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
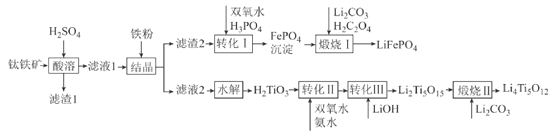
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__。
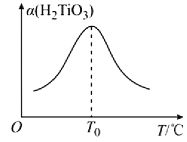
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__。
(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:
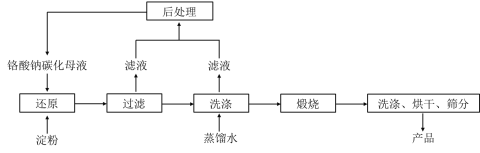
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是_____(填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
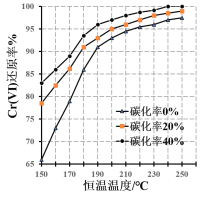
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________。
(4)滤液中所含溶质为_______。该水热法制备氧化铬绿工艺的优点有_________、________(请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
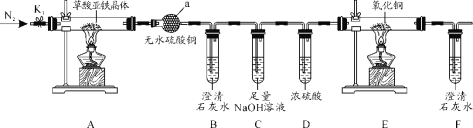
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲烷燃料电池采用铂作电极催化剂,用KOH作为电池中的电解液,其工作原理的示意图如下:
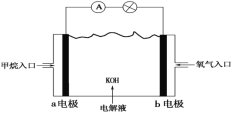
请回答下列问题:
(1)甲烷燃料电池的能量转化主要形式是__________________。
(2)Pt(a)电极是电池的________极,电极反应式为________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为________________。
(3)电池的总反应方程式为_______________________________。
(4)如果该电池工作时电路中通过4 mol电子,则消耗的CH4有________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4.2H2O的一种实验流程如图:
![]()
![]()
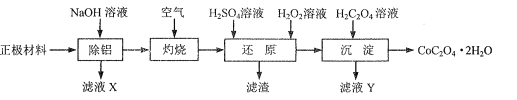
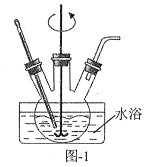
(1)“除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有___。
(2)“灼烧”的主要目的是___。
(3)“还原”步骤温度在70℃左右,LiCoO2发生反应的化学方程式为___。若该步骤用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但其缺点是___。
(4)“沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是___。
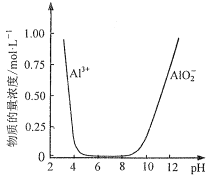
(5)设计由“滤液X”制备纯净的Al2O3的实验方案。(已知含铝物种浓度与pH的关系如图所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL 0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
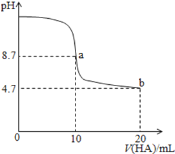
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. b点所示溶液中c(A-)>c(HA)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳键的长度完全相等
③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷(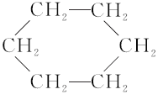 )
)
④经实验测得对二甲苯(![]() )只有一种结构
)只有一种结构
⑤苯在溴化铁作催化剂条件下同液溴可发生取代反应,但不能因化学反应而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2CH2CH2CH3和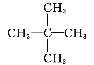 互为同分异构体
互为同分异构体
B.干冰和冰不是同一种物质
C.CH2 =CH2和CH2=CHCH3互为同系物
D.C4H10的一氯代物有三种
查看答案和解析>>
科目: 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com