
科目: 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目: 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成原电池。
①H2SO4所含化学键为____________;
②若有0.4mole-流过导线,则理论上负极质量减少____________g;
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是____________(填“锌极”或“铜极”),原因是____________(用电极方程式表示);
(2)①T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
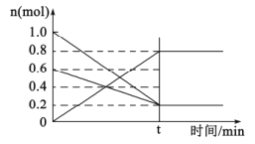
A.反应中NO与O2的物质的量之比为2:1
B.混合气体的总质量不随时间的变化而变化
C.单位时间内每消耗2nmolNO2,同时生成nmolO2
D.2v正(O2)=v逆(NO)
E.混合气体的压强不变
②0~t时间段,反应速率v(NO2)=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水热法制备直径为1-100nm的颗粒Y(化合物),反应原理为3Fe2++2![]() +O2+aOH-=Y+
+O2+aOH-=Y+![]() +2H2O,下列说法中不正确的
+2H2O,下列说法中不正确的
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.Fe2+、![]() 都是还原剂
都是还原剂
D.每有3molFe2+参加反应,反应中转移的电子总数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
B | 向某溶液中逐滴加入盐酸 | 产生无色无味气体 | 此溶液中含有 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
D | 先向某溶液中逐滴加入氯化钡溶液,再加稀硝酸 | 有白色沉淀产生,且沉淀不溶解 | 此溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
A. CO2、H2、CH3OH、H2O的浓度一定相等
B. 该反应已经达到化学平衡状态
C. CO2和H2完全转化为CH3OH和H2O
D. CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣amolL﹣1,c(OH﹣)=10﹣bmolL﹣1,已知a+b=12,则:
(1)该温度下水的离子积常数KW=_______;
(2)该NaOH溶液的物质的量浓度的精确值是______molL﹣1;
(3)在该温度下,将100mL 0.1molL﹣1的稀硫酸与100mL 0.4molL﹣1的NaOH溶液混合后,溶液的pH=______;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前 a与b之间应满足的关系是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
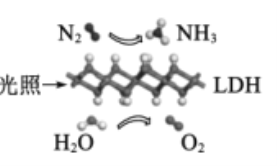
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目: 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
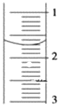
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com