
科目: 来源: 题型:
【题目】补铁剂常用于防治缺铁性贫血,其有效成分一般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:
(1)能表示能量最低的亚铁离子的电子排布式是_________(填标号)。
a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是_____,碳原子的杂化方式是______;琥珀酸亚铁中存在配位键,在该配位键中配位原子是____,中心原子是____。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:
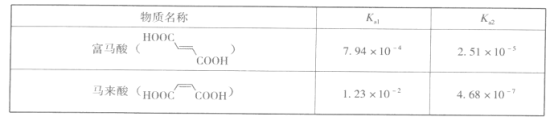
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:____。
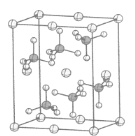
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a= 870 pm、b=680 pm、c=479 pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有____种空间取向,晶胞体内硫酸根离子的个数是____,铁原子周围最近的氧原子的个数为____;设阿伏加德罗常数的值为NA,则该晶体的密度是____ g·cm-3(列出计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 核磁共振氢谱、红外光谱都能够快速精确地测定有机物的相对分子质量
B. 异戊烷和新戊烷可以用质谱法快速的区分
C. 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体
D. ![]() 互为同系物
互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____,反应进行程度最大的是_____。
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________(填化学式)。

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
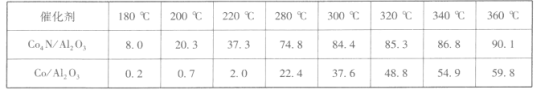
分析上表数据可知:_____(填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
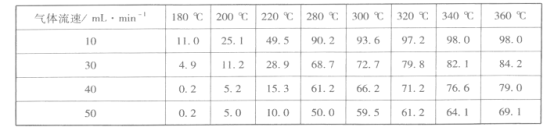
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____(填“增大”或“减小”),其可能的原因是_________________________________。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________(列出计算表达式)。
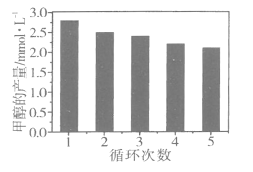
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________。(已知Co的性质与Fe相似)
查看答案和解析>>
科目: 来源: 题型:
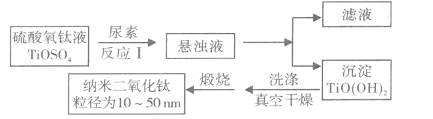
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:
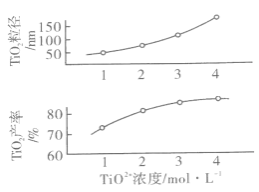
结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是( )

A.可用BaCl2溶液除去粗盐中的SO![]()
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.试剂1可以选用石灰乳
D.工业上,通常电解氯化镁溶液来冶炼金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
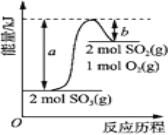
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com