
科目: 来源: 题型:
【题目】将3.48g四氧化三铁完全溶解在100mL 1mol/L硫酸中,然后加K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液物质的量浓度是 ( )
A. 0.05mol/LB. 0.1mol/LC. 0.2mol/LD. 0.3mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】H5IO6(正高碘酸)是用于光度法测定苯肼的试剂。工业上用NaIO3制备H5IO6的流程如图:
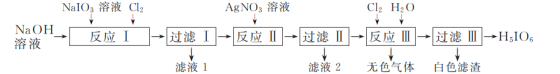
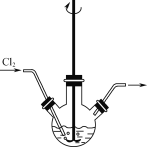
(1)“反应Ⅰ”可在如图所示的装置中进行。该反应生成不溶于水的Na2H3IO6的离子方程式为____。若要提高Cl2的利用率,可对装置进行改进的措施为___。
(2)反应Ⅱ生成不溶于水的黑色Ag5IO6,“滤液2”呈__(填“酸”“碱”或“中”)性。
(3)“无色气体”为__(填化学式)。
(4)工业上为降低成本,减少对环境的污染,整个流程需要控制加入Cl2和AgNO3的物质的量之比为n(Cl2)∶n(AgNO3)=__。
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
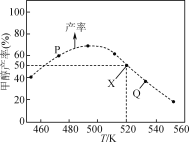
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
科目: 来源: 题型:
【题目】3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
铜与浓硝酸可能发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸铜的物质的量为![]() =0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
=0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
【点睛】
考查化学方程式的计算。注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键。铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量。
【题型】单选题
【结束】
11
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.钢铁零件“发蓝”实质上是使铁表面钝化
B.上述反应中,铁被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反应中转移2mol电子,生成还原产物8.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将1.0Lwmol·L-1CH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图所示。下列叙述正确的是( )
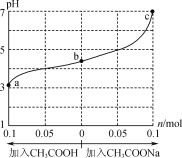
A.b点溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b点到a点的过程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
D.25℃时,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )
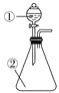
A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
【答案】D
【解析】
A.浓硫酸具有吸水性,浓盐酸具有挥发性,浓硫酸吸收浓盐酸中的水分导致浓盐酸浓度增大而加强其挥发性,浓硫酸和盐酸都是强酸,该实验体现浓盐酸的挥发性和浓硫酸的吸水性,故A错误。
B.常温下浓硫酸和Cu不反应,所以没有明显现象,故B错误。
C.浓硫酸具有吸水性,能吸收五水硫酸铜中的结晶水而使五水硫酸铜变为无水硫酸铜,固体由蓝色变为白色,该实验为化学变化,故C错误。
D.浓硫酸能将有机物中的H、0元素以2:1水的形式脱去而体现脱水性,还能将蔗糖脱水后形成的碳单质. 氧化为二氧化碳.同时还生成刺激性气味的二氧化硫,体现了浓硫酸的强氧化性.故D正确。
答案选D。
【题型】单选题
【结束】
9
【题目】已知NH4NO3在空气中爆炸时的反应为4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得。下列叙述正确的是( )
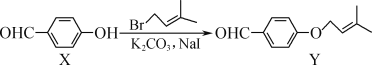
A.Y的分子式为C12H14O2
B.可用FeCl3溶液鉴别X和Y
C.Y能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
D.1molX与4molH2完全加成所得产物分子中含2个手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔH>0,ΔS<0
B.常温下,将稀CH3COOH溶液加水稀释,溶液中![]() 的值不变
的值不变
C.在铜的精炼过程中,若转移1mol电子,则阴极析出Cu的质量为32g
D.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则其热化学方程式为N2(g)+3H2(g)=2NH3(g);ΔH=-38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com