
科目: 来源: 题型:
【题目】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________,基态Ga原子核外电子占据最高能级的电子云轮廓图为________。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________。
(3)NF3的立体构型为_______。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______,氮原子的杂化轨道类型为__________。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________。
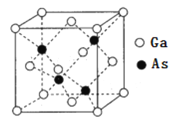
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为![]() ,_______。
,_______。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加德罗常数的值,晶体的密度为___________g/cm3(填写表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】计算填空:
(1)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________
(2)当SO2、SO3的质量比为1∶1时,氧原子数之比为________
(3)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,电子转移发生在不同物质的同种元素之间的是
A.2H2S + SO2=3S↓ + 2H2O
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.CuO + H2SO4=CuSO4 + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中既是化合反应又是氧化还原反应的是
A.CaO + H2O = Ca(OH)2B.Ca + Cl2![]() CaCl2
CaCl2
C.Fe + CuSO4 = FeSO4 + CuD.H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应能用离子方程式2H+ + CO32-=CO2↑ + H2O表示的是
A.HCl溶液与MgCO3反应
B.CH3COOH与K2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应
D.H2SO4溶液与(NH4)2CO3溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是工农业生产中重要的基础物质,研究合成氨及氨的应用具有重要意义。
(1)已知:N2(g)+3H2(g)=2NH3(g)ΔH=-92kJ/mol,N2(g)+3H2(g)![]() 2NH3(g)的活化能为508kJ/mol。则2NH3(g)
2NH3(g)的活化能为508kJ/mol。则2NH3(g)![]() N2(g)+3H2(g)的活化能为___________kJ/mol
N2(g)+3H2(g)的活化能为___________kJ/mol
(2)我国科研人员研制出Ti-H-Fe双温区催化剂(Ti-H区与Fe区温差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如下图一,其中吸附在催化剂表面的物种用“*”标注。
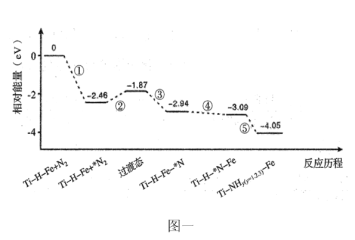
下列说法中正确的是___________。
A.①为![]() 的断裂过程
的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂时合成氨反应转变为吸热反应
(3)以氨和CO2为原料合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图二中曲线Ⅰ、Ⅱ、Ⅲ表示在不同水碳比[
CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图二中曲线Ⅰ、Ⅱ、Ⅲ表示在不同水碳比[![]() ]时,CO2的平衡转化率与氨碳比[
]时,CO2的平衡转化率与氨碳比[![]() ]之间的关系。
]之间的关系。
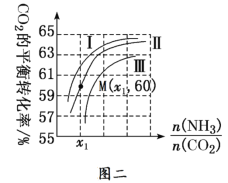
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是________,判断依据是________。
②测得M点氨气的平衡转化率为40%,则x1=______。
(4)将氨氧化法制硝酸过程中氨经催化氧化后的气体(高于800℃)急剧冷却到100℃以下,一方面除去大量的H2O,使NO(g)和O2(g)发生反应,另一方面温度低有利于生成NO2(g)。
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g)(反应快,瞬间达到平衡)ΔH1<0
N2O2(g)(反应快,瞬间达到平衡)ΔH1<0
v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(反应慢)ΔH2<0
2NO2(g)(反应慢)ΔH2<0
v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
其中k1、k2是速率常数,随温度上升而增大。
则:①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_____,根据速率方程分析,升高温度该总反应速率减小的原因是__________。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_____,根据速率方程分析,升高温度该总反应速率减小的原因是__________。
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则可能变为相应的点为__(填字母)。

查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,不属于氧化还原反应的是__________(填代号,下同),H 2 O 2 仅体现还原性的反应是__________。
(2)上述反应说明H2O2 、Ag2O、K2CrO 4 氧化性由强到弱的顺序是_________________
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4— 、H2O、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
①反应体系选择的酸是:____________ A.盐酸 B.硫酸 C醋酸
②该反应的离子方程式为________________________________________。
③如果上述反应中有2.24L(标准状况)气体生成,转移的电子为 _______mol.
(4)H2O2 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2 +H2O=A+NH3↑,试指出生成物A的化学式为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】与100mL0.5mol/LNaCl溶液所含的Cl-物质的量相同的溶液是
A.50 mL1mol/LNaCl溶液B.200mL0.25mol/L AlCl3溶液
C.100 mL0.5mol/LMgCl2溶液D.25mL0.5mol/LHCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】按照如图所示装置进行实验,填写有关现象及化学方程式。
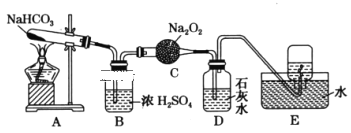
(1)A中现象是___。
(2)B中浓硫酸的作用是___。
(3)C中发生反应的化学方程式为___。
(4)D中的现象是___,发生反应的离子方程式是___。
(5)E中收集的气体是___(填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com