
科目: 来源: 题型:
【题目】含![]() 族的磷、砷(
族的磷、砷(![]() )等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的磷中,电离最外层一个电子所需能量最小的是__________(填标号)。
A.![]() B.
B. ![]() C.
C.![]() D.
D.![]()
(2)常温下![]() 是一种白色晶体,由
是一种白色晶体,由![]() 、
、![]() 两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知
两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知![]() 、
、![]() 两种微粒分别与
两种微粒分别与![]() 、
、![]() 互为等电子体,则
互为等电子体,则![]() 为________,其中心原子杂化轨道类型为________,
为________,其中心原子杂化轨道类型为________,![]() 为________。
为________。
(3)![]() 的
的![]() 、
、![]() 、
、![]() 分别为
分别为![]() 、
、![]() 、
、![]() ,根据结构与性质的关系解释
,根据结构与性质的关系解释![]() 远大于
远大于![]() 的原因______________。
的原因______________。
(4)![]() 的空间构型为_____________。
的空间构型为_____________。
(5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(![]() )照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数
)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图所示,晶胞参数![]() 。
。
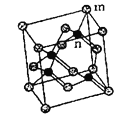
①砷化镓的化学式为__________,镓原子的配位数为__________。
②砷化镓的晶胞密度__________![]() (列式并计算,
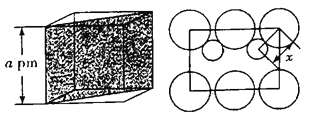
(列式并计算,![]() ,精确到小数点后两位),如图是沿立方格子对角面取得的截图,
,精确到小数点后两位),如图是沿立方格子对角面取得的截图,![]() 位置
位置![]() 原子与
原子与![]() 位置
位置![]() 原子的核间距x=________
原子的核间距x=________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语正确的是( )
A. 某元素基态原子的电子排布图![]()
B. NH4Cl电子式为[![]() :H]+Cl-
:H]+Cl-
C. Ca2+基态电子排布式为1s22s22p63s23p6
D. α羟基丙酸(乳酸)的比例模型为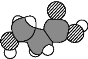
查看答案和解析>>
科目: 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目: 来源: 题型:
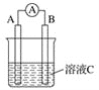
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他们对钠在CO2气体中燃烧进行了下列实验:
(1)若用下图装置制备CO2,则发生装置中反应的离子方程式为_________。
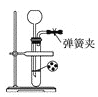
(2)将制得的CO2净化、干燥后由a口缓缓通入下图装置,待装置中的空气排净后点燃酒精灯,观察到玻璃直管中的钠燃烧,火焰为黄色。待冷却后,管壁附有黑色颗粒和白色物质。
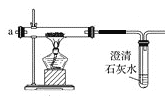
①能说明装置中空气已经排净的现象是_________。
②若未排尽空气就开始加热,则可能发生的化学反应方程式主要为_________。
(3)若钠着火,可以选用的灭火物质是_________。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(4)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是_________。
(5)为确定该白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaCl2溶液 | 出现白色沉淀 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,___成立(填序号)。
②由实验得出:钠在CO2中燃烧的化学方程式为_____;每生成1mol氧化产物,转移的电子数为____。
(6)在实验(2)中还可能产生另一种尾气,该气体为________;处理该尾气的方法为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰苯胺(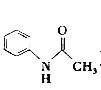 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(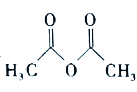 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为![]() ,易溶于有机溶剂。在水中的溶解度如下。
,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/( | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):
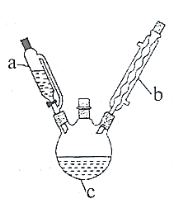
Ⅰ.粗乙酰苯胺的制备。将![]() 乙酸酐放入三口烧瓶
乙酸酐放入三口烧瓶![]() 中,在
中,在![]() 中放入
中放入![]() 新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流
新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流![]() ,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有
,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有![]() 冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入![]() 烧杯中,加入
烧杯中,加入![]() 热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸
热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸![]() ,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为
,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为![]() 。
。
回答下列问题:
(1)仪器![]() 的名称是______________。
的名称是______________。
(2)写出制备乙酰苯胺的化学方程式______________。
(3)步聚I中,减压过滤的优点是_____;用滤液而不用蒸馏水冲洗烧杯的原因是_________;洗涤晶体最好选用________(填字母)。
A.乙醇 B.![]() C.冷水 D.乙醚
C.冷水 D.乙醚
(4)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是______________。
(5)步骤Ⅱ中,干燥前的操作是______________。上述提纯乙酰苯胺的方法叫_____________。
(6)乙酰苯胺的产率为______________。(计算结果保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(![]() )是一种清洁能源,可由合成气(
)是一种清洁能源,可由合成气(![]() 、
、![]() )来制备,反应原理如下:
)来制备,反应原理如下:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
回答下列问题:
(1)上述反应符合“原子经济性”原则的是__________(填“反应Ⅰ”或“反应Ⅱ”)。
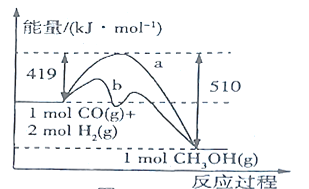
(2)图中使曲线![]() 对应反应按曲线
对应反应按曲线![]() 进行的措施是__________,由合成气(
进行的措施是__________,由合成气(![]() 、
、![]() )制备
)制备![]() 的热化学方程式为__________,该反应自发进行的条件为_________(填“低温”或“高温”)。
的热化学方程式为__________,该反应自发进行的条件为_________(填“低温”或“高温”)。
(3)模拟该制备原理,起始时在某容器中充入![]() 和
和![]() 合成
合成![]() ,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
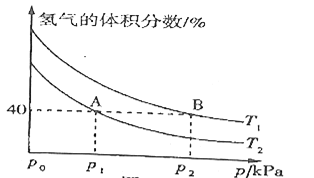
①下列有关说法能够证明恒温恒压时,反应![]()
![]() 一定达到平衡状态的是__________(填序号)。
一定达到平衡状态的是__________(填序号)。
![]() .
.![]() 和
和![]() 的转化率相等
的转化率相等
![]() .反应体系中混合气体密度保持不变
.反应体系中混合气体密度保持不变
![]() .
.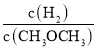 的值保持不变
的值保持不变
![]() .反应体系压强保持不变
.反应体系压强保持不变
②图中![]() ________
________![]() (填“>”“<”或“=”);理由是____________。
(填“>”“<”或“=”);理由是____________。
③在![]() 、
、![]() 两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:
两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:![]() _____
_____![]() 。
。
④![]() 点对应的
点对应的![]() _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中P元素的化合价为___。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为__________(填化学式)。
③从分类来看,NaH2PO2属于______
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式_______Ba(H2PO2)2与H2SO4的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com