
科目: 来源: 题型:
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
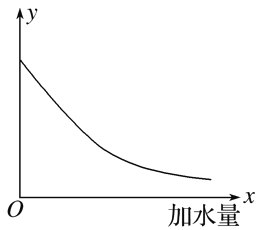
A. 溶液中H+的物质的量
B. 溶液中的c(CH3COO-)/c(CH3COOH)
C. 溶液的导电能力
D. CH3COOH的电离程度
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是___。
(3)若A容器和B容器的体积比为3∶2,则气体O2和气体O3质量之比为___,密度之比为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组需要1 molL﹣1的CuSO4 溶液80 mL,现用胆矾(CuSO4·5H2O)来配制,请回答下列问题:
(1)需称取胆矾 ______g。
(2)配制过程中,不需要的仪器(填序号)________。
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.蒸发皿
完成配制实验还缺少的仪器是________。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有_____(填序号)。
①转移前,容量瓶中含有少量蒸馏水 ②转移时有少量液体溅出
③定容时,俯视刻度线 ④颠倒摇匀后发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是
A. 100 mL 1 mol/L的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢
C. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法中正确的是
A. 氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B. 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目小于0.6×6.02×1023
D. 已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH的溶液混合,放出的热量要小于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com