
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C.B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,D与水反应又可生成A.试回答下列问题:

(1)写出下列物质的化学式:B________、C_________、E___________。
(2)写出B与水反应的离子方程式:_________________________________
(3)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____(填字母)
A.④和⑤ B.只有③ C.③和④ D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图像。____________________
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是____________________。
(3)图中5号元素在周期表中的位置是________周期________族。
(4)图中出现的元素中最活泼的金属元素位于元素周期表的________周期________族。
(5)写出图中6号元素的价电子排布式:________。
(6)分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围________<Al<________(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯如图所示,下列说法正确的是
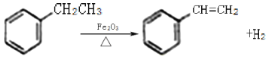
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件的水溶液中不能大量共存的粒子组是( )
A.在碱性溶液中:Na+、K+、![]()
![]()
B.既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、![]() 、ClO-、
、ClO-、![]()
C.含Fe3+的溶液:Na+、Mg2+、![]() 、I-
、I-
D.CH3COOH溶液:![]() 、Cl-、Cu2+、
、Cl-、Cu2+、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
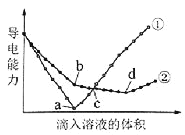
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)SO2和SO3是硫的两种氧化物,等温等压下,等质量的SO2和SO3所含分子个数比为________,氧原子个数比为________,等温等压下气体体积比_____________。
(2)100mL的某气体的质量为0.143g,该气体的相对分子质量:______________,
(3)设NA为阿伏加德罗常数的数值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积约是___________L(用含NA的式子表示)。
(4)配制100 mL1 mol/L的H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为__________mL。
(5)10.6gNa2CO3溶于水,配成500mL的溶液,溶液中溶质的物质的量________,Na+的物质的量浓度______________。
(6)标准状况下,5.6LNH3中氢原子的数目为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列4个化学反应中,与其他3个反应类型不同的是( )
A. CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
B. CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
C. 2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
D. CH3CH2OH+HBr→CH3CH2Br+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com