
科目: 来源: 题型:
【题目】装置甲、乙、丙都是铁与水蒸气反应的实验装置


下列说法不正确的是( )
A. 甲装置中氯化钙的作用是除去氢气中混有的水蒸气
B. 选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面
C. 用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声
D. 三个装置相比较,乙装置简单、操作简便、节约原料、安全性好
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量的关系不是1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.3NO2+H2O===2HNO3+NO
C.3S+6NaOH===Na2SO3+2Na2S+3H2O
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以α-锂辉石为原料制备碳酸锂,其工艺流程如图:

已知:①α-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,α-锂辉石在高温下可转化为β-锂辉石,β-锂辉石具有更高的化学活性。
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为___,1000℃焙烧α-锂辉石的目的为___。
(2)滤渣2的主要成分为___,调节pH值的范围为___。
(3)“除大部分Mg”步骤的离子方程式为___。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、___。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为___。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiMn1.5Ni0.5O4作为正极材料,以可传导放电Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-xMn1.5N0.5O4+Lix(CoP3)n![]() LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
LiMn1.5Ni0.5O4+(CoP3)n,则该电池放电时负极的电极反应式为___,充电时阳极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以异丙苯为起始原料,按下列路线合成植物香料花青醛。

已知:(l)RX![]() RMgX
RMgX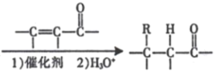 ( R 表示烃基);
( R 表示烃基);
(2)RCHO + R'CH2CHO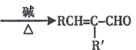 (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
(1)下列说法正确的是__________(填序号)。
A.异丙苯到化合物C 共经历了三步取代反应
B.常温常压下,化合物D可溶于NaOH 溶液
C.化合物B具有弱碱性
D.花青醛的分子式是C13H18O
(2)写出化合物E的结构简式___________。
(3)写出反应①的化学方程式___________。
(4)设计从乙烯到F 的合成路线(用流程图表示,无机试剂任选)_______。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式______。1H-NMR谱和IR谱检测表明:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( )
A. 在常温常压下,11.2LO2含有的分子数为0.5NA
B. 71gCl2所含原子数为2NA
C. 标准状况下,22.4LH2O含有的分子数为1NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反应,生成Na2SO4和NaCl。则Na2SX 中的 x=__________(写出简要计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O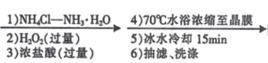 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体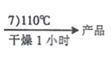
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是s能级和p能级的原子轨道图,试回答下列问题:
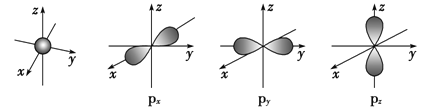
(1)s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是_______,它的氢化物的电子式是____________。若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为________,原子的电子排布图为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是___________,违反了洪特规则的是____________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(2)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na____Mg,Mg_____Ca。
②电负性:O______F,F______Cl。
③能量高低:ns______(n+1)s,ns______np。
④主族序数______价电子数______元素最高正化合价。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一包固体粉末,其中可能含有如下五种物质:CaCO3、K2CO3、Na2SO4、NaCl、CuSO4。现进行如下实验:①溶于水得无色溶液,溶液中无沉淀出现;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。根据上述实验现象推断:
(1)一定不存在的物质是_____________________;
(2)写出加入盐酸时沉淀消失的离子反应方程式___________________________;
(3)可能存在的物质是___________;
(4)写出下列物质在水溶液中的电离方程式
H2CO3:___________________________;
NH4HCO3 :___________________________;
Ca(OH)2:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com