
科目: 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Fe2+、K+、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含K+
B.肯定含有SO32-、K+
C.肯定不含SO42-
D.肯定含有NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为___________________________________________。
(2)固体E所含物质的化学式为__________________________________。
(3)反应①的离子方程式为________________________________________。
(4)写出向A中加入过量的氢氧化钠的离子方程式________________________________,__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中错误的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是还原剂
D.NH4H固体投入少量的水中,有两种气体产生
查看答案和解析>>
科目: 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
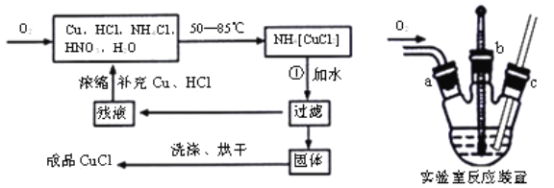
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
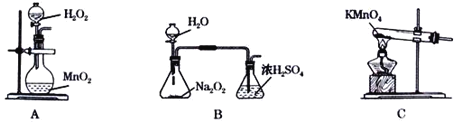
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。实验室利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
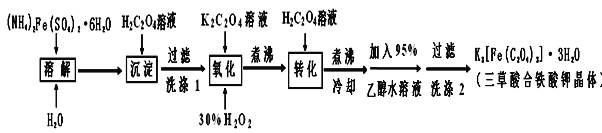
已知:沉淀: FeC2O4·2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3↓、2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
(1)溶解时加几滴稀硫酸的目的是___________________________。
(2)沉淀过滤后,洗涤1的操作方法是______。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40 ℃ 左右,可能的原因是____________。加入30%过氧化氢溶液完全反应后,煮沸的目的是________ 。
(4)洗涤2中所用洗涤试剂最合适的是________(填选项字母)。
A 草酸钠溶液 B 蒸馏水 C 乙醇 D KCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
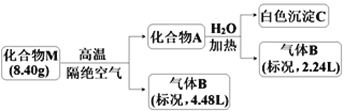
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
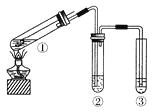
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭恒温容器中进行下列反应:aA(g)![]() bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
A.化学计量数a>b
B.容器容积增大,平衡向逆反应方向移动
C.容器容积增大,生成物B的质量分数增大
D.该反应的正反应放出热量
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
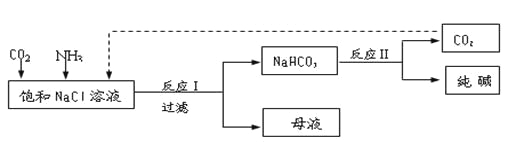
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中冷水的作用是_________;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为______;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
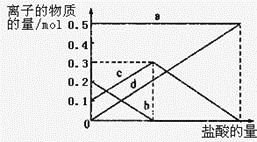
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是___________; 21
(4)若取21.0 g NaHCO3固体,加热了t2rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 molL—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com