
科目: 来源: 题型:
【题目】2019年2月,在世界移动通信大会(MWC)上,发布了中国制造首款5G折叠屏手机的消息。手机电池的工作原理是LiCoO2+C=Li1-xCoO2+LixC 下列说法不正确的是( )

A.制造手机芯片的关键材料硅,是非金属元素
B.用铜制作的手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.这种手机电池工作时,没有氧化还原反应发生
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
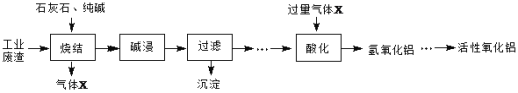
(1)烧结产物主要有NaAlO2、CaSiO3、NaFeO2及气体X。气体X是_________。
(2)烧结产物NaAlO2也可以通过所学知识由Al2O3转化得到,写出反应的离子方程式____
(3)写出由氢氧化铝制备氧化铝的化学方程式:____________________。
(4)碱浸前需将烧结产物进行粉碎,其目的是_________。碱浸过程中,NaFeO2可与水应生成NaOH和一种含铁的化合物,写出该反应的化学方程式_________________。
(5)某同学设计了由废渣(Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤。请利用所学和流程中的信息补充完整:向一定量滤渣中加入足量的稀硫酸,充分反应,无不溶物后,滴加NaOH溶液至生成的沉淀不再减少,过滤,__________,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶。(实验中必须使用的试剂:CO2气体、稀硫酸、蒸馏水)
(6)已知试剂EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应。现测定硫酸铝晶体样品中Al2(SO4)3·18H2O(摩尔质量为666g/mol)质量分数的实验步骤如下:(杂质不与EDTA反应)
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却。
步骤3:再向上述溶液中加入c2 mol·L- 1Pb(NO3)2 溶液V2mL 恰好与过量的EDTA溶液完全反应。
请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。__________(写出具体计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮及其化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180kJ·mol1
2NO(g) ΔH1=+180kJ·mol1
②NO2(g)+CO(g)![]() NO(g)+CO2(g) ΔH2=-235kJ·mol1
NO(g)+CO2(g) ΔH2=-235kJ·mol1
③2NO(g)+O2(g)![]() 2NO2(g) ΔH3=-112kJ·mol1
2NO2(g) ΔH3=-112kJ·mol1
则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的ΔH=__kJ·mol1,有利于提高CO平衡转化率的条件是__(填标号)。
N2(g)+2CO2(g)的ΔH=__kJ·mol1,有利于提高CO平衡转化率的条件是__(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入2molNO、2molCO,达到平衡时CO的转化率是50%,其平衡常数为__。
(2)在密闭容器中充入10molCO和8molNO,发生反应,如下图为平衡时NO的体积分数与温度,压强的关系。
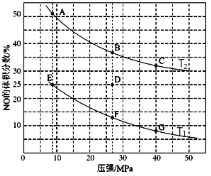
①由图判断,温度T1__T2(填“低于”或“高于”),理由是__?升高温度时,下列关于该反应的平衡常数(K)和速率(v)的叙述正确的是__填标号)。
A.K、V均增加 B.K增加,v减小
C.K减小,V增加 D.K、V均减小
②压强为20MPa、温度为T2下,若反应进行到10min达到平衡状态,容器的体积为2L,则此时CO的转化率=__,用CO2的浓度变化表示的平均反应速率v(CO2)=__,该温度下,如图所示A、B、C对应的pA(CO2)、pB(CO2)、pC(CO2)从大到小的顺序为__。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的__点。
(3)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。
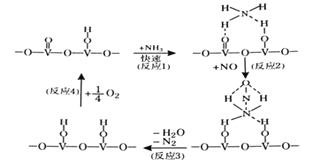
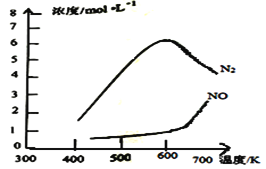
测得该反应的平衡常数与温度的关系为1gK=5.08+217.5/T,该反应是__反应(填“吸热”或“放热”)。该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为__;当温度达到700K时,发生副反应的化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
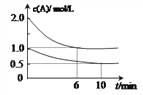
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
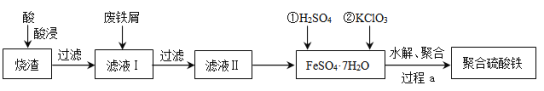
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法.图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
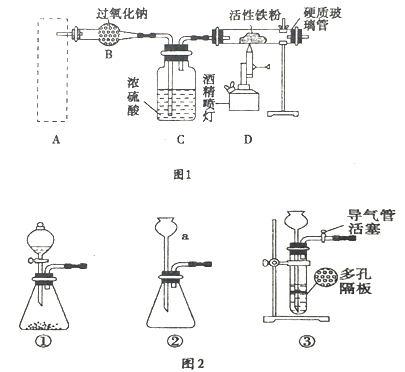
请回答下列问题:
(1)图2中仪器a的名称是___________.
(2)根据题目要求,在图2中最好选择______(填序号)作为A装置.
(3)对图2中装置①进行气密性检查的方法是___________,向分液漏斗中加足量水,过一会儿,水不再下滴,说明装置①的气密性良好.
(4)在B装置中发生主要反应的化学方程式是_________________.
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是___________________________________________.
(6)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解.
①写出溶解过程发生反应的离子方程式_____________________________.
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】以NA代表阿伏加德罗常数,且已知C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol,则下列说法中正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol,则下列说法中正确的是( )
A.当有20NA个电子转移时,热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2600 kJ/mol
B.当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
C.若生成NA个水蒸气分子的焓变为ΔH',则ΔH'<ΔH
D.题给反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯化铵溶液呈酸性:NH4+![]() NH3+H+
NH3+H+
B.氢硫酸的电离:H2S ![]() 2H++S2-
2H++S2-
C.向小苏打溶液中加入醋酸溶液:HCO3- +H+= CO2↑+H2O
D.在标准状况下,向 10mL0.1mol/FeBr2溶液中通入22.4 mLCl2:2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com