
科目: 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe3H2O+CO2↑
FeCO3不溶于水,易被氧化,4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图:
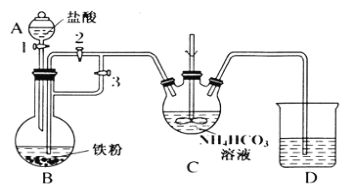
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式_________。
(2)待D处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是_____。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。加入少量铁粉的作用是_______。
(4)反应结束后,无需过滤,除去过量铁粉的方法是_________。
(5)从所得溶液中获得乳酸亚铁晶体的方法是:________,冷却结晶,过滤, 用适量乙醇洗涤,干燥。
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是___。
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+=Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500molL-1Ce(SO4)2标准溶液滴定至终点,记录数据如表。
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.20 | 19.95 |
2 | 0.10 | 21.65 |
3 | 0.95 | 20.60 |
则产品中乳酸亚铁的质量分数为________%。(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭在高温下制取氮化铝。 请回答下列问题:
(1)请写出制取氮化铝的化学方程式________。
制得的AlN样品仅含有Al2O3杂质,已知:AlN+NaOH+H2O=NaAlO2+NH3↑为测定AlN含量,设计如下三种实验方案。(测定过程均忽略NH3在强碱溶液中的溶解)
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
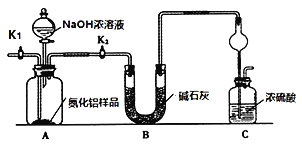
实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(2)图中C装置中球形干燥管的作用是________。
(3)通入氮气的目的是_______。
(4)图中装置会导致测定结果_______(填“偏高”“偏低”或“无影响”)。
(方案2)用如图装置测定mg样品中AlN的纯度(部分夹持装置已略去)。
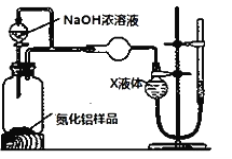
(5)为测定生成气体的体积,量气装置中的X液体可以是___(填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AlN的质量分数是______。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会_____(填“偏高”“偏低”或“无影响”)。
(方案3)按以下步骤测定样品中A1N的纯度:(过滤时使用无灰滤纸过滤)
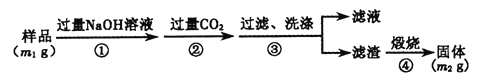
(7)步骤②生成沉淀的离子方程式为_______。
(8)样品中A1N的质量分数为_______(用含m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
C.检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D.检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种有机物,它们的转化关系如图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.
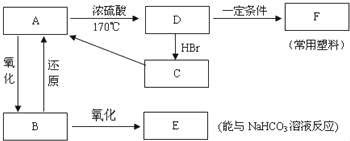
(1)A、B、C的结构简式分是 、 、 .
(2)B、C中所含官能团的名称分别是 、 .
(3)A到D的反应类型为 .
(4)C→A的反应条件是 .
(5)D→F反应的化学方程式是 .
(6)在一定的条件下,A与E反应可生成一种具有香味的物质.该反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下面是几种实验中常用的仪器:
|
|
|
|
A | B | C | D |
写出序号所代表的仪器的名称:B___________;C___________;D___________。
II.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制490 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时仰视观察凹液面。________________
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。________________
③该同学取他所配制的0.400 mol·L-1的盐酸去中和含0.4 g NaOH的NaOH溶液,结果发现所取盐酸的体积比所计算的25mL要小,则可能的原因是________
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
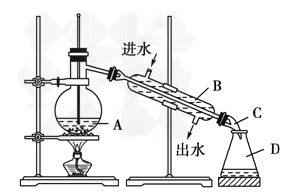
(5)实验过程中用到蒸馏水。如右图为实验室制取蒸馏水的装置示意图。请改正图中的两处明显的错误:________________;________________。实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________。
(2)已知:Se+2H2SO4(浓)![]() 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O![]() Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3![]() Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3![]() Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. 已知4℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(液) | 170g | 9.2g | 1.5×10-4g | 33. 3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为_____________________,在液氨中形成复分解反应的化学方程式为______________________________。
II. 现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦ 红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH-![]() H2O,该离子反应对应的化学方程式为 _____________________________________________
H2O,该离子反应对应的化学方程式为 _____________________________________________
(2)⑩在水中的电离方程式为 ____________________________________
(3)少量的④通入⑥的溶液中反应的离子方程式为_____________________________
过量的④通入⑥的溶液中反应的离子方程式为_______________________________
(4)⑥与过量的碳酸氢钠溶液反应离子方程式:_________________________________
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
用双线桥标明电子转移的方向和数目__________________________________________,
当有5.4g Al发生反应时,转移电子的数目为 ____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】VL浓度为0.5mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2VL
B.将溶液加热浓缩到0.5VL
C.加入10mol.L-1的盐酸0.1VL,再稀释至1.5VL
D.加入VL1.5mol.L-1的盐酸混合均匀
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)具有复合官能团的复杂有机物,其官能团具有各自的独立性,在不同条件下所具有的化学性质可分别从各官能团讨论。如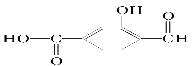 具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
具有三种官能团:______、__________和__________(填官能团的名称),所以这个化合物可看作______类,______类和______类。
(2)羟基的电子式是___________________________。
(3)(CH3CH2)2C(CH3)2的名称为_________________________。
(4)2-甲基-1,3-丁二烯的键线式___________________________。
(5)![]() 该有机物发生加聚反应后,所得产物的结构简为______。
该有机物发生加聚反应后,所得产物的结构简为______。
(6)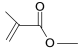 分子式为_______________________结构简式为______________________。
分子式为_______________________结构简式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com