
科目: 来源: 题型:
【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
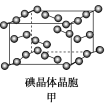
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
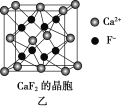
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )

A. 盐酸的体积为80mlB. a的取值范围为0≤ a <50
C. n(Mg2+)<0.025molD. 当a值为30时,b值为0.01
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CO2和NH3为原料合成尿素。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=-159.47 kJ·mol-1
NH2CO2NH4(s) ΔH1=-159.47 kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g) ΔH3
CO(NH2)2(s)+H2O(g) ΔH3
回答下列问题:
(1)在相同条件下,反应Ⅰ分别在恒温恒容容器中和绝热恒容容器中进行,二者均达到平衡后,c(CO2)恒温________c(CO2)绝热(填“大于”“小于”或“等于”);ΔH3=____________。
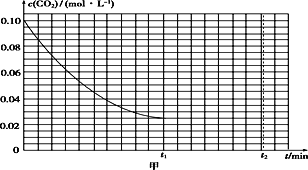
(2)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4 mol NH3和0.2 mol CO2放入容积为2 L的密闭容器中,t1时达到化学平衡,c(CO2)随时间t变化曲线如图甲所示,在0~t1时间内该化学反应速率υ(NH3)=____________;若其他条件不变,t1时将容器体积压缩到1 L,t2时达到新的平衡。请在图甲中画出t1~t2时间内c(CO2)随时间t变化的曲线。___________________________________
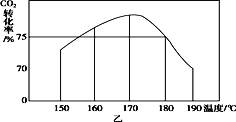
(3)在150 ℃时,将2 mol NH3和1 mol CO2置于a L 密闭容器中,发生反应Ⅲ,在t时刻,测得容器中CO2转化率约为73%,然后分别在温度为160 ℃、170 ℃、180 ℃、190 ℃时,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线(见图乙)。在150~170 ℃之间,CO2转化率呈现逐渐增大的变化趋势,其原因是__________180 ℃时反应Ⅲ的平衡常数K=____________(用含a的式子表示)。
(4)侯氏制碱法主要原料为NaCl、CO2和NH3,其主要副产品为NH4Cl,已知常温下,NH3·H2O的电离常数Kb=1.8×10-5,则0.2 mol·L-1 NH4Cl溶液的pH约为________(取近似整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目: 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:
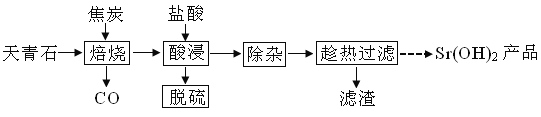
已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】将12.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌B.镁和铜C.铝和镁D.钠和铁
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将0.0l mol L -1 NaOH溶液滴入20mL0.01mol·L-1CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
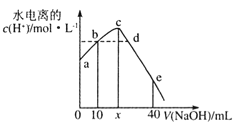
A. x=20,a点的纵坐标为1.0×10-12
B. b点和d点所示溶液的pH相等
C. 滴定过程中,c(CH3COO-)与c(OH-)的比值逐渐增大
D. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( )
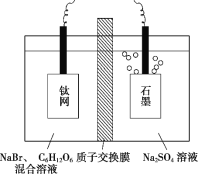
A.钛网与直流电源的正极相连,发生还原反应
B.石墨电极的反应为2H2O+2e-=H2↑+2OH-
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
查看答案和解析>>
科目: 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示,下列说法正确的是( )

A. 铝球表面有气泡产生,溶液中有白色沉淀生成;杠杆不平衡
B. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出;溶液蓝色变浅,杠杆右边下沉
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com