
科目: 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
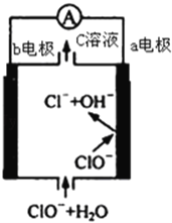
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)设计简单实验证明CH3COOH为弱酸__。
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”):
n(H+)=___,![]() =___,
=___,![]() =__,c(OH-)=___。
=__,c(OH-)=___。
(3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是__(填写序号)
①反应需要的时间:CH3COOH>HCl
②开始反应的速率:HCl>CH3COOH
③参加反应的锌粉的物质的量:CH3COOH=HCl
④反应过程的平均速率:CH3COOH>HCl
⑤盐酸中有锌粉剩余
⑥CH3COOH溶液中有锌粉剩余
(4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是__。
A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体
(5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是对某溶液进行离子检测的方法和结论,其中正确的是( )
A. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B. 加入足量的CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO![]()
C. 加入NaOH溶液后加热产生有刺激性气味的气体,则溶液中一定含有大量的NH![]()
D. 先加入适量的盐酸酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年9月12日11时26分,我国在太原卫星发射中心用长征四号乙运载火箭,成功将资源一号02D卫星发射升空。资源一号02D卫星将为国家自然资源资产管理和生态监理工作提供稳定的数据保障,同时兼顾防灾减灾、环境保护、城乡建设、交通运输、应急管理等相关领域应用需求。
(1)卫星改变运行的路线时需要喷火消耗燃料,其燃料一般是肼(N2H4)。肼中N的化合价是___,肼在空气中燃烧的化学方程式如下,请用双线桥法标出该反应中电子转移的方向和数目___。
N2H4+O2![]() N2+2H2O
N2+2H2O
该反应中的氧化剂是___,被氧化的元素是___,每生成1molH2O转移电子___mol。
(2)近几年来,太原市在环境保护方面采取了一系列措施,其中的喷雾车、洒水车都是为了降低空气中的粉尘。含有粉尘的空气是否属于胶体___(填“是”或“否”),证明的方法是___,观察到的现象是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是()
A.2g氢气中的原子数为NA
B.1mol/LCaCl2溶液中Cl- 数为2NA
C.标准状况下22.4LCO2中原子数为3NA
D.2L2mol/LC2H5OH溶液中分子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国人自古就有泡药酒的习惯。药酒多选用50-60度的白酒,将中药材浸泡在酒中,经过一段时间,中药材中的有效成分(主要是有机物)溶解在酒中,此时即可过滤去渣后饮用。泡药酒的原理属于

A.萃取B.结晶C.干燥D.置换
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法正确的)

A. 该试剂的物质的量浓度为 9.2 mol·L —1
B. 该硫酸 50 mL 与足量的铜反应可得到标准状况下 SO2 10.3 L
C. 配制 200 mL 4.6 mol·L —1 的稀硫酸需取该硫酸 50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于 49%
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com