
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素,X、Z和W的原子最外层电子数之和为20。回答下列问题:
(1) W在元素周期表中的位置是__________。
(2)X和Y元素简单离子的半径较大的是________(填离子符号);Z和W元素气态氢化物的稳定性较弱的是__________(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是__________(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述,不正确的是
A. 正戊烷、异戊烷、新戊烷的沸点依次降低
B. 相对分子质量为104的烃,分子中不可能只存在单键
C. 光照下2,2一二甲基丙烷与Br2反应其二溴取代物有两种
D. FeCl3溶液可以把4种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液一一区分
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00mL 0.200 0 mol/LNH4Cl溶液中逐滴加入0.2000 mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
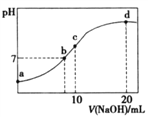
A. a点溶液中:c(H+)+c(NH3·H2O)=c(OH-)+c(NH4+)
B. b点溶液中:c(Cl-)=c(Na+)>c(H+)=c(OH-)
C. c点溶液中:c(NH3·H2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. d点溶液中:c(Cl-)> c(NH3·H2O)> c(OH-)> c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )
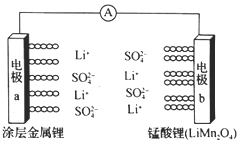
A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目: 来源: 题型:
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。
(1)1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被_______(填“氧化”或“还原”)
(2)贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是_____________________。
(3)泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是__________________。
(4)盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是_____________。
(5)1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是___________________(用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
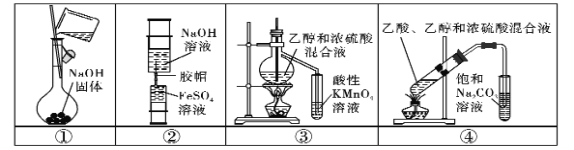
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
样品12.0 g ![]() 溶液
溶液![]() 沉淀
沉淀![]() 固体19.7 g
固体19.7 g
(1)如何检验氯化钡溶液已过量____________
(2)检验沉淀是否洗涤干净所用到的试剂是____________
(3)样品中Na2CO3的质量分数为_________(小数点后保留1位)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
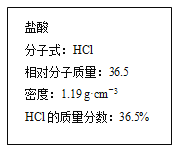
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是 _______、
③配制时,下列操作正确的顺序是(用字母表示)______。
A. 洗涤 B. 定容 C. 稀释 D. 摇匀 E. 冷却 F. 量取 G. 转移
④在配制过程中,下列实验操作使配制的稀盐酸的物质的量浓度偏小的是_______
A. 用量筒量取浓盐酸时俯视刻度线
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C. 配制时,容量瓶有少量蒸馏水
D. 定容时俯视容量瓶的刻度线
E. 转移完溶液后未洗涤玻璃棒和烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com