
科目: 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
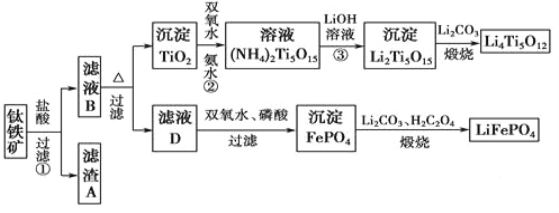
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
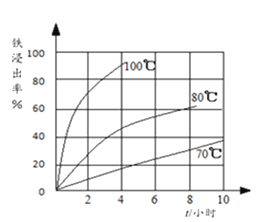
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是
①水的摩尔质量是18g
②0.5molH2的体积为11.2L
③1 mol 水中含有 2 mol 氢和 1mol 氧
④1mol 任何物质都约含有6.02×1023个分子
⑤0.5mol H2SO4含有的原子数目为3.5NA
⑥只有在标准状况下,体积相同的任何气体所含的分子数相同
⑦质量分数为40%的硫酸溶液与等体积的水混合,所得溶液浓度大于20%
⑧物质的量浓度为4mol/L 的硫酸溶液与等质量的水混合,所得溶液浓度小于2mol/L
A. ①③④⑤⑦⑧ B. ②⑤⑦⑧ C. ⑤⑦⑧ D. ⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
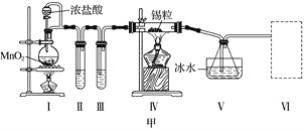
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
②Ⅵ处装置最好选用________(填字母)。
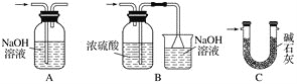
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
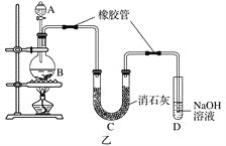
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
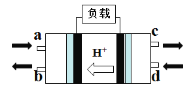
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
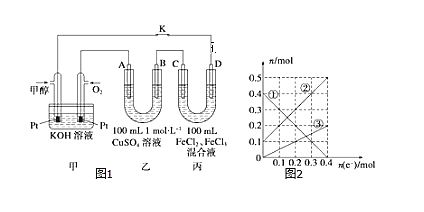
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】120℃、101.3 kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】图表示可逆反应A(s)+B(g) n C(g);ΔH=Q kJ·mol1,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的
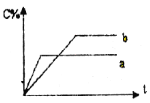
A. 若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B. 只改变温度,则a比b的温度高,且Q>0
C. 只改变压强,则a比b的压强大,n>2
D. 由图象可以作出判断,反应一定从正反应方向开始
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com