
科目: 来源: 题型:
【题目】很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。
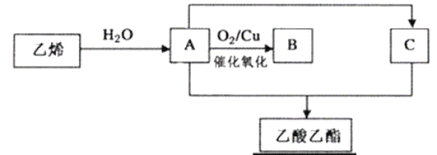
请回答下列问题:
(1)B的结构简式为______________。
(2)乙烯与水反应生成A的反应类型为______________。
(3)A与C反应生成乙酸乙酯的化学方程式为__________,其反应类型为__________。
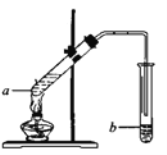
(4)实验室可用如图装置制取乙酸乙酯。
①在试管a中加好相关试剂后,还需要加入2—3块的碎瓷片,其作用是__________。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的_______(填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是________。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液。
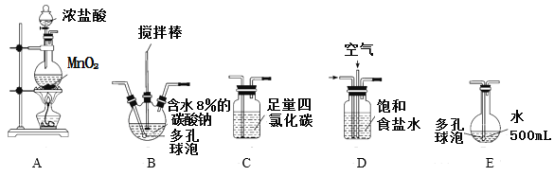
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置A中反应的离子方程式是__________________________。
(3)实验中控制氯气与空气体积比的方法是_____________________。
(4)反应过程中,装置B需放在冷水中,其目的是_________________________。
(5)装置E采用棕色圆底烧瓶是因为______________________。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(7)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
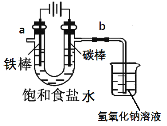
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
科目: 来源: 题型:
【题目】结合图回答问题:如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
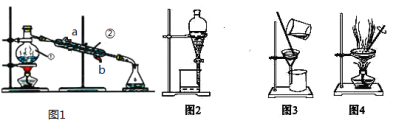
(1)写出上述装置中仪器的名称:①________。
(2)若利用上述装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,图1中仪器 ②是从______口进水(填a或b)。
(3)图2在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______
(4)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的序号,下同);除去自来水中的Cl等杂质,选择装置______。
(5)实验室常用上述装置分离碘水中的碘,进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定条件下,28.80g金属单质A与1.20molCl2完成反应,生成1.20molAClx,则x=__________,若A原子核内质子数等于中子数,则A原子核内中子数为__________ ,氯原子结构示意图为____________。
(2)现有氨气3.4g,在标准状况下其体积为____________,含有氮原子的数目为_____ ;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。液体A和气体B的组合不可能是( )
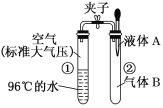
A. 氢氧化钠溶液、一氧化氮
B. 水、氨气
C. 氢氧化钠溶液、二氧化碳
D. 水、二氧化氮
查看答案和解析>>
科目: 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 2C(g)+D(g)相同条件下的反应速率,反应速率最快的是( )
2C(g)+D(g)相同条件下的反应速率,反应速率最快的是( )
A. v(A)= 0.5mol/ (L·min)B. v(B)=0.03mol/ (L·s)
C. v(C)=0.35mol/ (L·min)D. v(D)=0.4mol/ (L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是组成人体细胞的主要元素及其比例:下列相关叙述中,错误的是( )

A.组成人体细胞的主要元素是碳、氢、氧、氮、磷等
B.在人体细胞中含量最多的元素是氧
C.构成人体细胞的最基本元素是碳
D.其他元素含量小于3%,所以作用也很小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com