
科目: 来源: 题型:
【题目】常温下,XOH、YOH及ZOH三种一元碱的物质的量浓度均为0.100 mol·L-1,体积均为10.00 mL,分别用0.100 mol·L-1的HCl溶液滴定,滴定曲线如图所示。下列说法正确的是
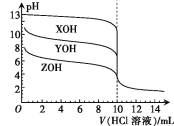
A.均可用酚酞作指示剂
B.电离平衡常数:Kb(YOH)<Kb(ZOH)
C.均滴入10.00 mL HCl溶液时,ZCl溶液中的水解程度最大
D.pH=11的YOH与pH=3的HCl溶液等体积混合:c(Cl-)>c(Y+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】科研人员设计的CO2资源化利用的装置如图所示(电解质溶液为稀H2SO4),下列说法错误的是
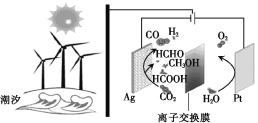
A.该离子交换膜为质子交换膜
B.Ag极上的电势比Pt极上的高
C.电路中每流过4 mol电子,阳极区质量减少36 g
D.太阳能、风能及潮汐能均是可再生能源
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol硫单质在过量氧气中燃烧产生NA个SO3分子
B. 标准状况下,22.4 L SO3中含有氧原子数为3NA
C. 标准状况下,18 g H2O中含有氧原子数为NA
D. 5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):
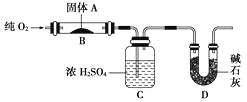
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
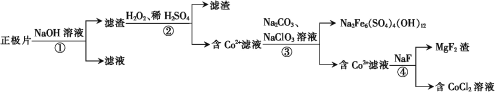
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com