
科目: 来源: 题型:
【题目】铁能形成多种化合物,如Fe(SCN)3,[Fe(CO)5](羰基铁),它们在生活生产中有广泛应用。
(1)Fe3+基态核外电子排布式为_____。
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为____ 。SCN﹣中的碳原子的杂化轨道类型为_____。与SCN﹣互为等电子体的分子是_____。
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为_____。
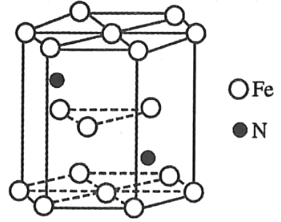
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 常温下2S2O(g)![]() 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D. 氯水通入SO2后溶液的酸性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在水体中部分含氮有机物循环如图1所示.
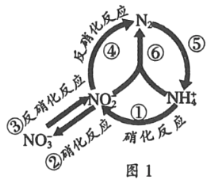
(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
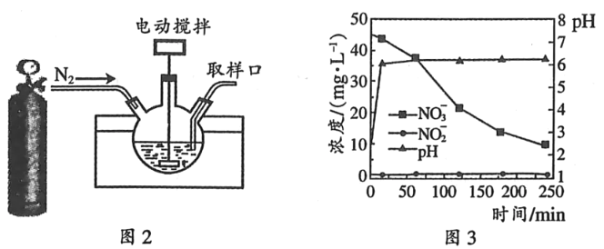
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
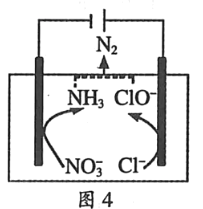
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若c1=2c2,则w1<2w2,V<50 mL
B. 若c1=2c2,则w1<2w2,V>50 mL
C. 若w1=2w2,则c1<2c2,V=50 mL
D. 若w1=2w2,则c1>2c2,V<50 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.质子数相同而中子数不同的同一种元素的不同原子互为同素异形体
B.铁是人体必需微量元素中含量最多的一种
C.在水溶液中能导电的物质一般是电解质,如HCl、H2O 、NH3、CH3COOH、NaOH、AgCl都是电解质
D.元素周期表中每一个纵列为一个族
查看答案和解析>>
科目: 来源: 题型:
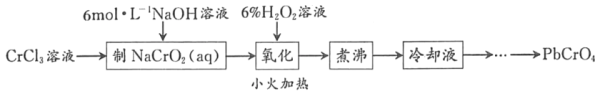
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:
已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
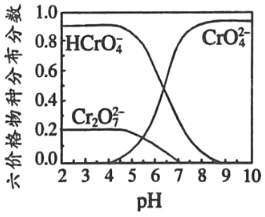
③六价铬在溶液中物种分布分数与pH关系如图2所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目: 来源: 题型:
【题目】在浓度均为3mol·L-1的H2SO4和NaOH溶液各100 mL中,分别加入等质量的铝粉,反应完毕后生成气体的质量比为4∶5,则加入铝粉的物质的量为( )
A.0.125molB.0.25molC.0.5molD.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.氢氧化铁胶体制备的化学方程式为:FeCl3+H2O![]() Fe(OH) 3 ↓+3HCl
Fe(OH) 3 ↓+3HCl
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至过量:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.少量氯气通入溴化亚铁溶液中:Cl2+2Br- =Br2+2Cl-
D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
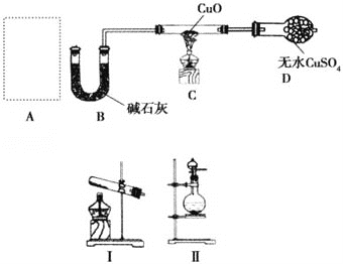
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com