
科目: 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
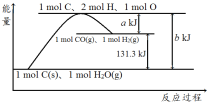
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目: 来源: 题型:
【题目】研究反应 2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是
Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是

A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在 0~10min 之间,实验③的平均速率 v(Y)=0.04 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】践行绿水青山就是金山银山的发展理念,就要做好大气污染和水污染防治。
(1)为落实“污水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
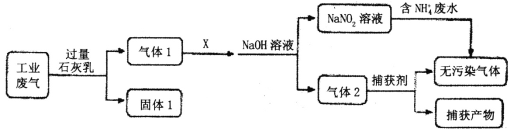
①气体l中主要含有___。
②已知X是空气,通入过量X是否合理__(填是或否),理由是__;NaNO2溶液综合处理含NH4+废水时,发生反应的离子方程式为___;捕获剂所捕获的气体成份主要是___。
(2)为了提高汽车尾气中NOx的去除率,有效降低柴油发动机在空气过量条件下的NOx排放,可以采用NSR(NOx储存还原)处理。其工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
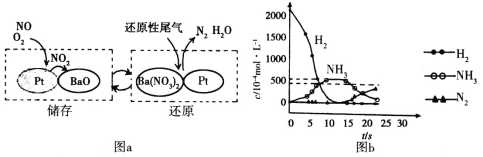
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应的化学方程式为__。
③有人根据上述模拟过程认为,使用了催化反应器虽然能将NOx转化为N2,但从环保角度汽车仍然需要限行。请简述限行的理由:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、二氧化碳、氧气作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”(碱式碳酸铜),“铜绿”能跟酸反应生成铜盐、二氧化碳和水。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于物质的类别是____。
(2)请写出铜绿与盐酸反应的化学方程式_____。
(3)写出B的化学式_____。
(4)上述转化过程中属于化合反应的是___,属于复分解反应的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,其制备原理为:![]()
甲、乙两同学分别设计了如下装置来制备乙酸乙酯。

请回答下列问题:
(1)下列说法不正确的是________。
A.加入试剂的顺序依次为乙醇、浓硫酸、乙酸
B.饱和碳酸钠的作用是中和乙酸、溶解乙醇、促进乙酸乙酯在水中的溶解
C.浓硫酸在反应中作催化剂和吸水剂,加入的量越多对反应越有利
D.反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,待液体分层后即可从上口倒出上层的乙酸乙酯
(2)乙装置优于甲装置的理由是________。(至少说出两点)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组进行化学实验,按照图(左)连接好线路发现灯泡不亮,按照图(右)连接好线路发现灯泡亮。由此得出的结论正确的是( )
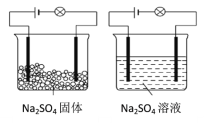
A.Na2SO4固体不导电,所以Na2SO4固体是非电解质
B.Na2SO4溶液能导电,所以Na2SO4溶液是电解质
C.Na2SO4在水溶液中电离方程式:Na2SO4=2Na++SO42-
D.Na2SO4溶液中,水电离出大量的离子
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
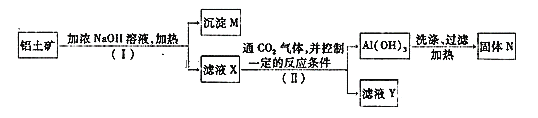
(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
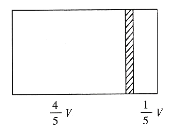
A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图。下列说法不正确的是

A. 酸溶时,常需将烧渣粉碎、并加入过量H2SO4,其目的是提高铁元素的浸出率,同时抑制铁离子的水解
B. 反应②的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+
C. 加入NH4HCO3生成FeCO3,检验FeCO3是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴如盐酸酸化的氯化钡溶液,若无沉淀生成说明洗涤干净
D. 锻烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
查看答案和解析>>
科目: 来源: 题型:
【题目】
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
____Al+____NaNO3+____NaOH=____NaAlO2+____ N2↑+___H2O
(4)若反应过程中转移5 mol 电子,则生成标准状况下N2的体积为_________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com