
科目: 来源: 题型:
【题目】某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是_____________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
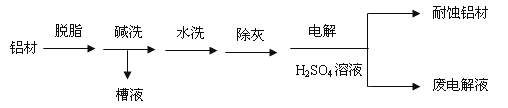
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的量的计算填空:
(1)2 mol尿素[CO(NH2)2]含_____________个H原子,所含氧原子跟__________g H2O所含氧原子个数相等。
(2)①标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是____________________。
(3)30.9 g NaR含有Na+0.3 mol,则NaR的摩尔质量为_________________。
(4)100mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol·L-1,则其中c(SO42-)=_________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目: 来源: 题型:
【题目】I.现有下列9种物质:①氧气;②二氧化硫;③稀硫酸;④铜;⑤氯化钡固体;⑥氢氧化钾固体;⑦硝酸钾溶液;⑧酒精(C2H5OH);⑨氧化钙固体,请将上述物质按要求完成下列问题(用相应化学式填空):
(1)属于酸性氧化物的有___________,属于电解质的是_______________________。
II.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(2)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是___________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)氢氧化铁胶体稳定存在的主要原因是______________(选填序号)。
A.胶体微粒直径小于1nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
查看答案和解析>>
科目: 来源: 题型:
【题目】利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准情况)
D.生成H2的量理论上等于0.48 g Mg与足量稀盐酸反应产生H2的量
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
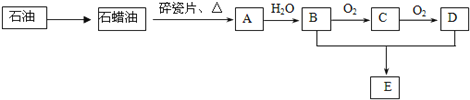
请回答下列问题:
(1)工业上,由石油获得石蜡油的方法是___________________。
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(—CH3),则这种同分异构体的结构简式是:___________________;D物质中官能团的名称是_______________。
(3)A、B共0.1 mol,完全燃烧消耗O2的体积是_______(标准状况下)。
(4)反应B→C的化学方程式为______________________。
(5)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=______kJ·mol-1。
CH3OH(g) ΔH=______kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应速率的是________(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系
如右图所示。
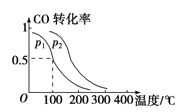
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
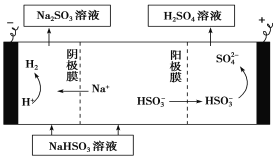
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:_____________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com