
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
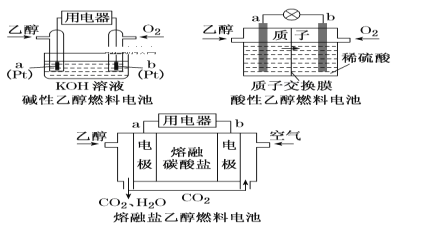
①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为________。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷与氯气光照条件下的产物有多种,其中三氯甲烷(氯仿)可用作麻醉剂。氯仿分子的空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2电池电解尿素CO(NH2)2的碱性溶液制备H2,下列说法不正确的是( )
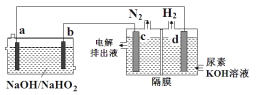
A.电解过程中,电子的流向由a→d→c→b
B.电池的正极反应为:HO2-+2e-+H2O=3OH-
C.电解时,消耗5.4gAl,则产生标况下2.24L N2
D.电极c是阳极,且反应后该电极区pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子,则X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 3a | 2a | b |
A.![]() 、4aB.
、4aB.![]() 、4aC.
、4aC.![]() 、8aD.
、8aD.![]() 、5a
、5a
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】今年是门捷列夫发现元素周期律 150 周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W 原子最外层电子数是其内层电子数的 3 倍。下列说法正确的是( )
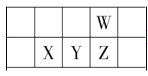
A.原子半径:W>X
B.最高价氧化物的水化物酸性:Y>Z
C.气态氢化物沸点:Z>W
D.气态氢化物热稳定性:Z<W
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.在镀件上电镀铜时,镀件应连接电源的负极
B.粗铜电解精炼时,若电路中通过2 mol e-,阳极减少64g
C.用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.6g,则:
(1)混合气体平均相对分子量为____;一氧化碳的质量为_____。
(2)将上述混合气体与标准状况下16.8L的氧所混合点燃,完全反应后,冷却至标准状况,反应后混合气体的平均相对分子质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
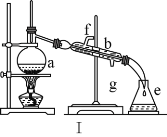
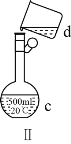
(1)写出下列仪器的名称:a.____,b._____,c.____。
(2)仪器ae中,使用前必须检查是否漏水的有____(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在____处。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
(4)现需配制0.13mol·L1NaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图。
①根据计算用托盘天平称取NaOH溶液的质量为_____g。为完成此溶液配制实验需要的玻璃仪器有______。
②图Ⅱ中的错误是_____。
③配制时,按以下几个步骤进行:计算、称量、溶解、冷却、转移、定容、摇匀、装瓶。操作中还缺少一个重要步骤是_____。
④取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_____(填字母)。
A.溶液中Na的物质的量 B.溶液的浓度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液浓度偏高的是_____。
A.暴露在空气中称量NaOH的时间太长
B.将砝码放在左盘上, NaOH放在右盘上进行称量(使用游码)
C.向容量瓶转移液体时,容量瓶内含有蒸馏水
D.溶解后未冷却至室温就转移至容量瓶
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
G.定容时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:

下列叙述正确的是
A. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. Na2CO3溶液不能与次氯酸发生反应
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-= CO32-+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
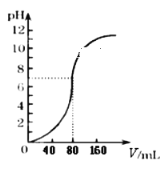
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com