
科目: 来源: 题型:
【题目】化学与生产、生活等密切相关,从化学视角回答下列问题:
(1)电闪雷鸣的雨天,空气中发生的化学反应会增加雨水的含氮量,有关反应的化学方程式是_____、_______、_________________。
(2)我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,有关反应的化学方程式为_______、______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中某此气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),用此装置和相关试剂不能制取的气体是( )
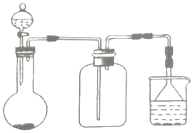
A.NH3B.SO2C.NO2D.Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(主要成分为Co2O3)制备LiCoO2的工艺流程如图:
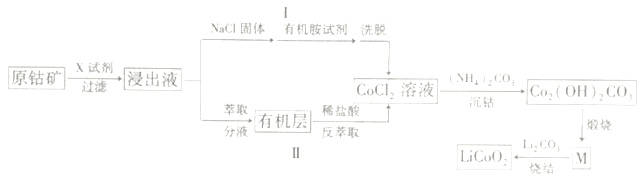
资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-![]() CoCl42-
CoCl42-
(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是___。
(2)若“X试剂”是盐酸,写出离子反应方程式___。
(3)途径I中加入NaCl固体的目的___(用平衡移动原理解释)。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是___。
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为___;写出“烧结”的化学方程式___。
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为___。
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下列物质:①氢氧化钠溶液、②铝片、③液态HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 气体、⑦碳酸氢钠、 ⑧氧化铝
(1)属于电解质的是______________________。(填编号)
(2)能导电的是____________________________________。(填编号)
(3)①和②反应的离子方程式________________________________。
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。_______________
(2)该反应的还原产物为__________。若反应中消耗1 mol K2Cr2O7,则转移电子数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100 mL1.5 mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。下列说法错误的是
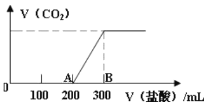
A.氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为Na2CO3和NaHCO3
B.盐酸的浓度为0.5 mol/L
C.B点产生的气体在标准状况下体积1.12 L
D.AB段发生反应的离子方程式为:HCO3- + H+ = H2O+ CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】光刻胶(I)是半导体制造的一种重要材料,其中一种合成路线如下,完成下列填空。
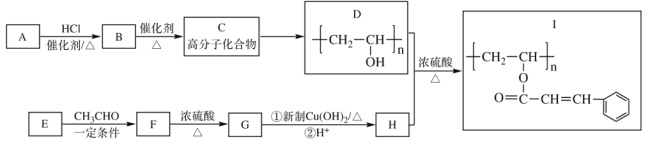
已知:![]()
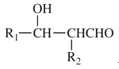
(1)A的电子式_____________,E的结构简式_____________;
(2)C→D反应的试剂和条件为_____________,F→G的反应类型_____________;
(3)D+H→I的化学反应方程式___________________________________________;
(4)H的芳香类同分异构体中,可以发生水解反应和银镜反应的有_________种;
(5)![]() 是重要的工业加工助剂,写出以乙烯和乙醛为原料制备
是重要的工业加工助剂,写出以乙烯和乙醛为原料制备![]() 的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A
的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A B
B 目标产物)___________________
目标产物)___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学为了测定工业纯碱的纯度,进行了一系列实验。
(1)和索氏制碱法相比,侯氏制碱法的优势有___________________________________;
(2)工业纯碱中常含有少量NaCl杂质,解释原因__________________________,检验是否含有氯化钠杂质的方法为__________________________________________________________;
(3)使用重量法测定纯碱的纯度,用到的试剂有__________________________________;
(4)使用滴定法测定纯碱的纯度,用_________________(填仪器名称)称量1.200g工业纯碱样品,溶解,用1mol/L盐酸做标准液,滴定过程中溶液pH变化和生成CO2的量如图所示,A点溶液呈碱性的原因______________________________________________________,计算该工业纯碱样品的质量分数_______________。(计算结果保留两位小数)
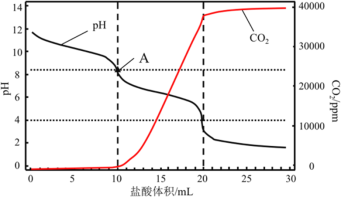 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),并达到平衡。
2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
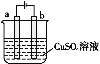
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com