
科目: 来源: 题型:
【题目】下图所示四种化学实验操作的名称按①②③④顺序排列分别为( )

A.过滤、蒸发、蒸馏、萃取(或分液或萃取分液)
B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D.萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目: 来源: 题型:
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘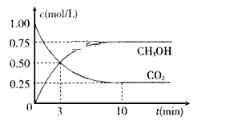
(1)该密闭容器的容积是______________L。
(2)达到平衡状态的时刻是_______________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_____________mol/(L·min)。
(CO2)=_____________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
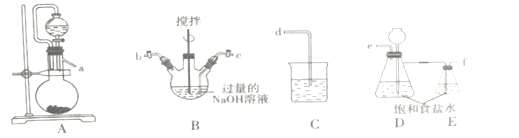
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
(2)电解法制备K2FeO4(如图):

该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
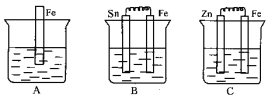
(1)A中反应的离子方程式为_________________________________。
(2)B中Fe极为_______极,电极反应式为_______________________。C中Fe极为_______极,电极反应式为__________________________,电子从_______极流出(填“Zn”或“Fe”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】误服铊盐会导致人体急性中毒,普鲁士蓝[KFe2(CN)6]可用作铊盐的解毒剂。
(1)Fe3+的价电子轨道表示式为___,与N同周期的主族元素中,第一电离能比N大的元素有___种。
(2)普鲁士蓝与硫酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___,分子的立体构型是___,分子中σ键与π键数目之比为___。
(3)普鲁士蓝中的化学键不含有___(填字母)。
a.离子键
b.共价键
C.配位键
d.金属键
(4)已知FexCy的晶胞结构如图所示,则其化学式为___,铁原子的配位数是___。
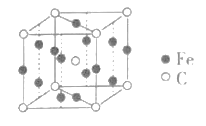
(5)如图为K2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρg·cm-3,试计算K+与S2-的最短距离为___nm(阿伏加德罗常数用NA表示)。
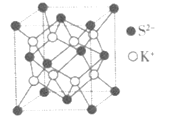
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,又能缓解能源危机。实现CO2资源化再利用的研究工作正在不断进行中。
(1)CO2和H2,合成CH3OH,用非金属催化剂实现CO2电催化还原制备甲醇的反应历程如图所示:
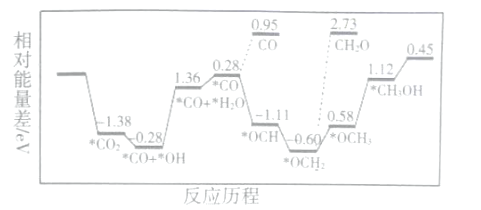
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C. *OCH2→*OCH3 D.*OCH3→*CH3OH
(2)CO2和H2合成甲酸(HCOOH)其反应为:H2(g)+CO2(g)![]() HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
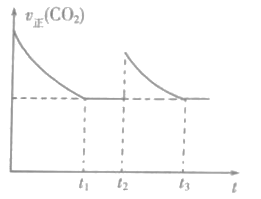
①t2时,改变的条件是充入amolCO2,同时___。
②下列关于t1、t3时刻的说法,正确的是___。
a.平衡常数:K1>K3
b.混合气的平均分子量:![]() <
<![]()
c.混合气中HCOOH的体积分数:V1=V3
③标准平衡常数Kθ=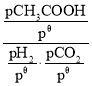 ,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
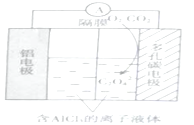
电池正极区发生的反应:①O2+e-=O2-;②___,O2的作用是___。
(4)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的KOH溶液,所得溶液的pH=3,则![]() =___。
=___。
(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,A、B、C三种气体在2L密闭容器中进行反应,在不同反应时间各物质的物质的量的变化情况如图所示。
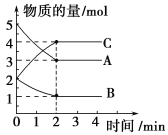
(1)该反应的化学方程式为___________________。
(2)反应开始至2 min时,用C表示的反应速率 = _____________。
(3)B的转化率= __________________。
(4)下列可判断反应已达到平衡状态的是___________。
a.A、B、C的反应速率相等 b.A、B的反应速率之比为2∶1
c.混合气体的压强不变 d.生成1 mol C的同时消耗1 mol A和0.5 mol B
e.混合气体的密度不变 f.混合气体的平均相对分子质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)已知两种同素异形体A、B的热化学方程式为:A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ·mol-1;B(s)+O2(g)═CO2(g)△H=﹣395.41 kJ·mol-1则两种同素异形体中较稳定的是(填“A”或“B”)______。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
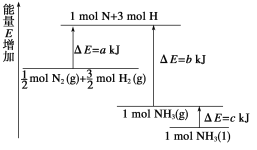
①1 mol N和3 mol H生成1 mol NH3(g)是_______能量的过程(填“吸收”或“释放”)。由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
(3)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1。该反应的热化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com