
科目: 来源: 题型:
【题目】现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡___移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___pH(乙)(填“大于”、“小于”或“等于)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)____c(CH3COO-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Zn+CuSO4=ZnSO4+CuB.3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C.AgNO3+KCl=AgCl↓+KNO3D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数等于2NA
B.标况下1molH2O的体积为22.4L
C.1mol Fe与足量盐酸充分反应失去电子数为3NA
D.1L 1mol·L-1K2CO3溶液中所含K+个数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是_______,有关反应的离子方程式为___________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为_________________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO3- C. CO32- D.OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO![]() 、H+、CO
、H+、CO![]() 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH![]() )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9kJ热量。则H2燃烧的热化学方程式为_____
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4kJ/mol
2NH3(g);ΔH=-92.4kJ/mol
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中加入催化剂引起反应速率变化的时间段是____(填,如0~t1等)。
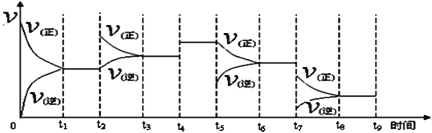
②生产中为提高反应速率和H2的转化率,下列措施可行的是___(填字母)。
A.向装置中充入过量N2 B.及时将合成的氨气从装置中分离出来
C.使用更高效的催化剂 D.升高温度
③温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____。
查看答案和解析>>
科目: 来源: 题型:
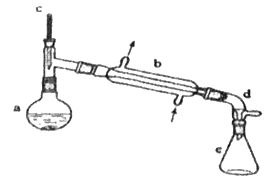
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()
![]() +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的__________(填“上口倒出”或“下口倒出”)。
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有_______(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一密闭容器中发生可逆反应:2E(g)![]() F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com