
科目: 来源: 题型:
【题目】下列实验方案与现象正确且能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案与现象 |
A | 证明新制氯水具有酸性 | 向新制氯水中滴加紫色石蕊试液,溶液变为红色且颜色保持不变 |
B | 证明酸性条件下,氧化性:H2O2 > Fe3 + | 向Fe(NO3)2溶液中滴加用硫酸酸化的H2O2溶液,溶液变黄色 |
C | 证明同温下,溶度积常数: Ksp(AgCl)> Ksp(Ag2CrO4) | 向体积为100 mL、浓度均为0.01 mol·L-1的NaCl和Na2CrO4混合溶液中滴加 0.01 mol·L-1AgNO3溶液,先产生白色沉淀,后产生砖红色沉淀Ag2CrO4 |
D | 证明溶液X中含有 | 向溶液X中先滴加盐酸无明显现象,再滴加BaCl2溶液,出现白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,把0.5molN2O4气体通入容积为5L的密闭容器中,60s时达到平衡,此时容器内的压强为起始时的1.6倍,求:
(1)在这60s内NO2的平均生成速率;_______
(2)达到平衡时N2O4的分解率。_______
(3)达到平衡时NO2 的体积百分含量_______
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
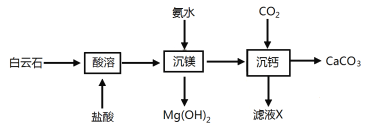
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
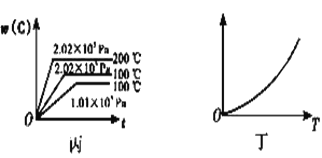
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
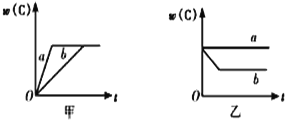
(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则_____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则____曲线表示恒温恒容的情况,且此时混合气体中w(C)____(填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是____(填“放热”或“吸热”)反应,x的值为____。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_____ (填序号)。
①w(C) ②A的转化率 ③压强 ④c(B)
查看答案和解析>>
科目: 来源: 题型:
【题目】旋烷是一类比较特殊的碳氢化合物,其张力较大。如下给出了几种旋烷的结构。下列说法不正确的是( )
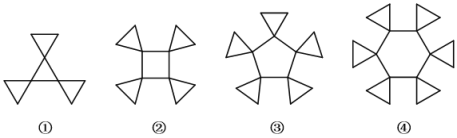
A.旋烷①与三甲苯互为同分异构体
B.旋烷②的二氯代物种类数小于其十四氯代物的种类数
C.1 mol旋烷③完全燃烧时消耗20 mol O2,生成10 mol H2O
D.旋烷系列分子中含碳量为0. 9
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示。请回答下列问题:
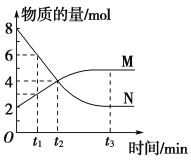
(1)该反应的化学方程式为___________。
(2)在t2时刻存在的等量关系是_____________,此时反应是否达到化学平衡状态?________(填“是”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用SO2还原MnO2制备MnSO4的装置如图所示,下列说法正确的是( )
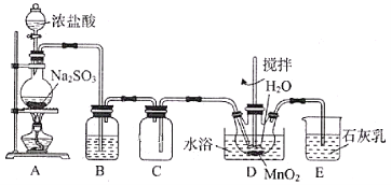
A.装置B中试剂可为Na2SO3溶液,其作用是除去SO2中的HCl
B.装置D中水浴温度应控制在80℃左右,温度过高时反应速率可能减慢
C.将装置D中所得MnSO4溶液蒸干可获得纯净的MnSO4·H2O
D.装置E中发生反应的离子方程式为SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中用图1所示的装置进行氨气的喷泉实验,实验结束后的情况如图2所示,下列说法正确的是
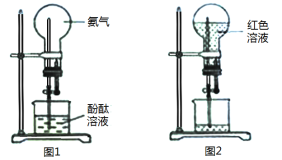
A.需要用热毛巾覆盖烧瓶底引发喷泉实验
B.红色溶液未充满是因为装置漏气
C.烧瓶中溶液呈红色是因为氨气能电离出OH-
D.若在标准状况下进行该实验,得到氨水的浓度是1/22.4mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
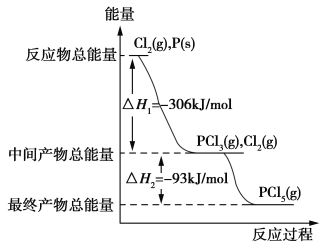
根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式为_____________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式为_____________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________(填“>”“<”或“=”)ΔH3。
查看答案和解析>>
科目: 来源: 题型:
【题目】锆石(ZrSiO4)酷似钻石且价格低廉,是钻石很好的代用品。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如下:
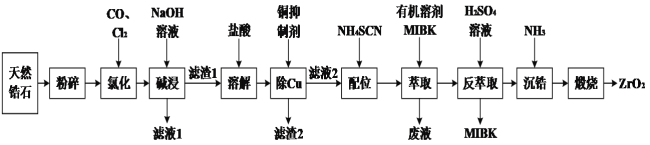
已知:i.氯化过程中除C、O外,其他元素均转化为其最高价氯化物;
ⅱ.Zr在化合物中通常显+4价;ZrC14易溶于水,400 ℃时升华;
ⅲ.“配合”生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)将锆石“粉碎”的目的是_______________________________。
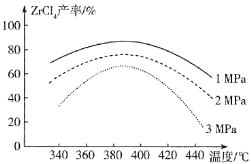
(2)“氯化”过程中,ZrSiO4发生反应的化学方程式为_______________,由下图可知,“氯化”过程选择的最佳反应条件是_________ ;若“氯化”温度过高会导致ZrC14产率降低,原因是________。
(3)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2,其Ksp=4.0×10-10。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,若溶液中Cu2+的浓度小于等于1.0×10-6mol·L-1时可视为沉淀完全,则Cu2+沉淀完全时溶液中CN-的浓度为________molL-1。
(4)由于NaCN有剧毒,所以需要对“废液”中的NaCN进行处理,通常选用漂白液(有效成分是NaClO)在碱性条件下将其氧化,其产物之一是空气中的主要成分,则上述反应的离子方程式为___________。
(5)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com