
科目: 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
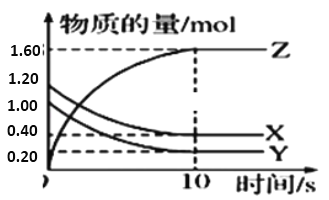
(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____ 。
(3)10s时,该反应 ___ 达到了化学平衡状态。(填“是”或“否”)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图曲线a表示可逆反应X(g)+Y(g)Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
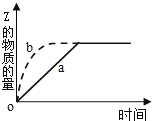
A.压缩反应容器的体积
B.加入一定量的Z
C.降低温度
D.减少X的投入量
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成
是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成![]() 固体,模拟工业上用过氧化氢法制备
固体,模拟工业上用过氧化氢法制备![]() 固体的实验装置如图所示。
固体的实验装置如图所示。
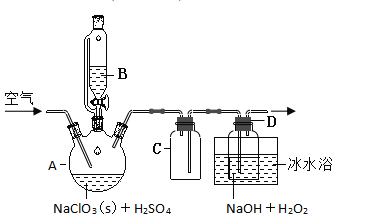
已知:![]() 熔点-59℃、沸点11℃、
熔点-59℃、沸点11℃、![]() 沸点150℃
沸点150℃
![]() 中的化学方程式:
中的化学方程式:![]()
(1)![]() 放入仪器
放入仪器![]() 中,仪器
中,仪器![]() 中的药品是__________(写化学式)。如果仪器
中的药品是__________(写化学式)。如果仪器![]() 改成分液漏斗,实验过程中可能会出现的实验现象__________。
改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)![]() 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向![]() 装置中通入空气,其作用是赶出
装置中通入空气,其作用是赶出![]() ,然后通过
,然后通过![]() 再到
再到![]() 中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
中反应。通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低![]() 的溶解度 b.减少
的溶解度 b.减少![]() 的分解 c.使
的分解 c.使![]() 变为液态 d.加快反应速率
变为液态 d.加快反应速率
(5)写出![]() 中发生反应的化学方程式__________,
中发生反应的化学方程式__________,![]() 在反应起到__________作用。假设在反应中消耗掉
在反应起到__________作用。假设在反应中消耗掉![]() 则有__________
则有__________![]() 电子转移。
电子转移。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某度旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如下表:

(1)滤液A的主要成分除NaOH外,还有_____________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______________________________________________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2
c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质.写出反应Ⅱ中CuS发生反应的化学方程式:____________________________________________。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)CO泄漏会导致人体中毒,用于检测CO的传感器的工作原理如图所示:写出电极I上发生的反应式:__。

工作一段时间后溶液中H2SO4的浓度__(填“变大”、“变小”或“不变”)
(2)用O2氧化HCl制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
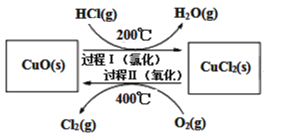
过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1
CuCl2(s)+H2O(g) H1
过程II反应的热化学方程式(H2用含有H和H1的代数式表示)__。
(3)在温度T0℃,容积为1L的绝热容器中,充入0.2molNO2,发生反应:2NO2(g)![]() N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
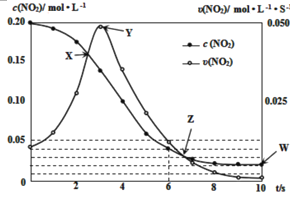
①反应到6s时,NO2的转化率是__。
②根据图示,以下各点表示反应达到平衡状态的是__。
a.X b.Y c.Z d.W
③0~3s内容器中NO2的反应速率增大,而3s后容器中NO2的反应速率减小了,原因是__。
④此容器中反应达平衡时,温度若为T1℃,此温度下的平衡常数K═__。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1molL-1的Na2SO3溶液吸收SO2,当溶液pH═7时,溶液中各离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)═c(OH-)。(已知25℃时:H2SO3的电离常数Ka1═1.3×10-2,Ka2═6.2×10-8)请结合所学理论通过计算说明c(HSO3-)>c(SO32-)的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应 A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
A.v(A)=0.15mol/(L·min)B.v(B)=0.6 mol/(L·min)
C.v(C)=0.4 mol/(L·min)D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛。下列反应不属于氧化还原反应的是( )
A. 木炭燃烧:C + O2 ![]() CO2
CO2
B. 加热碳酸镁:MgCO3 ![]() MgO + CO2 ↑
MgO + CO2 ↑
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 电解水:2H2O![]() 2 H2 ↑ + O2 ↑
2 H2 ↑ + O2 ↑
查看答案和解析>>
科目: 来源: 题型:
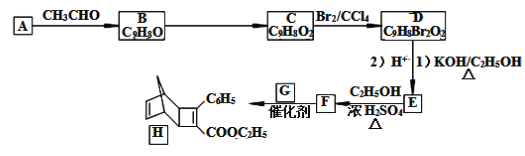
【题目】化合物H是一种有机光电材料中间体。实验室由芳香族化合物A制备H的一种合成路线如图:
已知:
①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)有机物A的名称是__。E所含官能团的名称是__。
(2)已知②中物质“||”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为___。
(3)H能发生的反应类型分别是___。
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)D→E的反应,若只把条件(1)改为KOH/H2O,则生成物E的结构简式是__。
(5)写出E→F的化学方程式__。
(6)G为甲苯的同分异构体,G的结构简式是__。
(7)参照如图合成路线,写出用A和CH3CHO为原料经以上合成路线制备化合物C(C9H8O2)的合成路线___(其它试剂任选)。
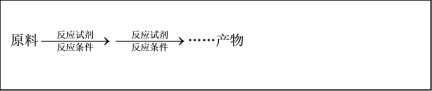
(8)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的X的结构简式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.V正(X)=V逆(Z)
C.容器内X、Y、Z的浓度之比为l∶2∶2
D.单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
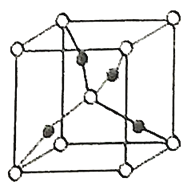
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com