
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
科目: 来源: 题型:
【题目】石灰石是一种化工原料,可以通过反应生成一系列物质,如图:

下列说法正确的是
A.漂粉精是混合物,有效成分是氯化钙
B.图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2
C.工业制漂粉精通常用氯气通入澄清石灰水中
D.制取纯碱和漂粉精所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)配制 500 mL 浓度为 0.2 mol·L-1 稀硫酸,需用量筒量取密度为 1.84 g·cm-3 溶质质量分数为98%的浓 H2SO4 __________mL,然后再与适量水混合稀释,待________ 后,再转移 到____中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_________ (填“大于”“小于”或“等于”)0.2 mol·L-1。
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度 (填 “大于”“小于”或“等于”)______________0.2 mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJmol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
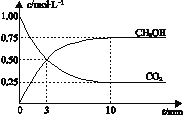
A. 升高温度能使![]() 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 molL-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是生活中常见的物质,请回答下列问题:
(1)写出纯碱在水溶液中电离的方程式:_________。
(2)纯碱属于“酸”“碱”“盐”中的_____。
(3)现有 10.6 g 纯碱,其物质的量为__________mol,将此固体溶于水配成 200 mL 溶液,其溶质的物 质的量浓度为_________ mol·L-1,取出 10 mL 此溶液加水稀释至 100 mL,其溶质的物质的量浓度 为___ mol·L-1,稀释后溶液中 Na+的物质的量为________ mol。
(4)①写出少量 CO2 与 NaOH 溶液反应的离子方程式: _____________
②写出过量 CO2 与 NaOH 溶液反应的离子方程式: _________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某铁和铜的固体混合物在空气中部分生锈(锈的成分为 CuO 和 Fe2O3),其总质量为 6.4 g,某实验小组对此固体混合物进行实验探究。

(1)操作 1 的名称为_____,此操作使用的玻璃仪器有_____、_____、_____。
(2)固体混合物中两种氧化物与稀硫酸反应的离子方程式为_____、_____。
(3)红色固体滤渣为_____(填“铜”或“氧化铁”)。
(4)查阅资料知 Cu+Fe2(SO4)3![]() CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
(5)“一系列操作”中,其中有一步反应如下,请将此反应方程式配平:
_____Fe(OH)2+_________O2+_____H2O![]() _____Fe(OH)3
_____Fe(OH)3
(6)通过进一步实验得出:浅绿色溶液中不含 Cu2+,则原部分生锈的固体混合物中氧元素的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐中常含 Ca2+、Mg2+、SO42-以及泥沙等杂质,一种制备精盐的实验方案及步骤如下(用于沉淀的试剂饱和 Na2CO3 溶液、BaCl2 溶液、NaOH 溶液均稍过量):
![]()
(1)若试剂①选用 NaOH 溶液,则试剂②产生的沉淀的化学式为 ___________。判断滴加试剂③ 已过量的方法是:__________。
(2)操作Ⅱ为___________。溶液丙中,溶质除 NaCl 外还含有____________(填化学式)等。
(3)食用盐常在精盐中加入 KIO3。为了检验实验中是否含 KIO3,可以用以下反应进行:KIO3+5KI+3H2SO4![]() 3I2+3K2SO4+3H2O。
3I2+3K2SO4+3H2O。
①用双线桥分析以上反应中电子转移的方向和数目:_____。
②反应中氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为: HUr(aq)+ Na+(aq) ![]() NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
NaUr(s) + H+(aq) +Q (Q>0),下列说法错误的是
A.寒冷季节更易诱发关节疼痛
B.饮食中摄入过多食盐,会加重痛风病病情
C.大量饮水会增大痛风病发作的可能性
D.患痛风病的人应少吃能代谢产生更多尿酸钠的食物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com