
科目: 来源: 题型:
【题目】常温下,向1mol/LNH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成,已知Ksp[Mg(OH)2]=1.8×1011。下列说法错误的是

A.常温下,NH4Cl的水解平衡常数数量级为1010
B.体系中,水的电离程度大小关系为![]()
C.![]() 点时,溶液中c(Mg2+)=0.18mol/L
点时,溶液中c(Mg2+)=0.18mol/L
D.a点溶液中,c(NH4+)+c(H+)<c(Cl)+c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用废铁屑(主要成分为Fe2O3、Fe,少量碳)制取碳酸亚铁(FeCO3),设计了如图流程,根据流程图,下列说法不正确的是
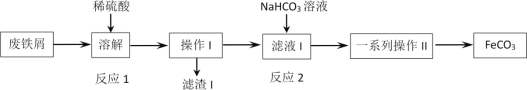
A.工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去
B.反应2的离子方程式:Fe2++HCO3-=FeCO3↓+H+
C.操作I为过滤,洗涤操作,一系列操作II为蒸发浓缩,冷却结晶,过滤,洗涤
D.为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298K时,Ksp(MnS)=4.65×1014,Ksp(MnCO3)=2.24×1011,298K下,MnS、MnCO3(R2代表S2或CO32-)在水中的溶解曲线如图所示,下列说法正确的是
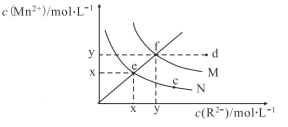
A.图象中x约等于2.2×107
B.其它条件不变,加热N的悬浊液可使溶液组成由e点沿ef线向f点方向移动
C.常温下,加水稀释M溶液可使溶液组成由d点沿df线向f点方向移动
D.向含有MnS和MnCO3的饱和溶液中加少量MnCl2,![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
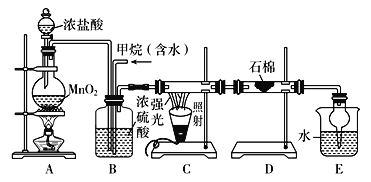
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x取值范围________。
=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)D装置的石棉中均匀混有KI粉末,其作用是______________。
(4)E装置的作用是________(填编号)。
A 收集气体 B 吸收氯气
C 防止倒吸 D 吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(6)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
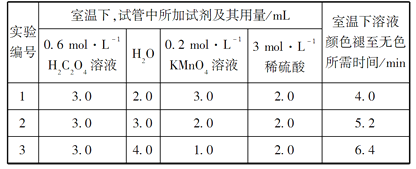
请回答:
(1)以上反应的化学方程式:__________________。
(2)根据上表中的实验数据,可以得到的结论是:_____________。
(3)利用实验1中数据计算,用KMnO4的浓度变化表示反应速率v(KMnO4)=_____。

(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:

(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】按下面各个小题的要求填空
(1)有下列各组物质,将符合下方描述的组合对应的字母填在横线上
A.O2和O3 B.12C和13C C.甲烷和庚烷D.CH3CH2CH2CH3和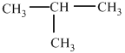 E.
E. 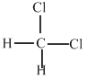 和
和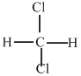
a.____________组两物质互为同位素。
b.____________组两物质互为同素异形体。
c.____________组两物质属于同系物。
d. ____________组两物质互为同分异构体。
(2)(1)①P4(s,白磷)+5O2(g)=P4O10(s) △H1=2983.2kJ/mol
②P(s,红磷)+5/4O2(g)=1/4P4O10(s),△H=738.5kJ/mol
根据上述信息,写出白磷转化为红磷的热化学方程式________.
(3)已知C2H4(g)和C2H5OH(l)的燃烧热分别是1141kJ/mol和1366.8kJ/mol,写出C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式:_______。
(4)某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜。某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下气体6.72L(其中NO2和NO的体积比为2:1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比___________。
②反应后得到的溶液中H+的浓度为1.0mol/L,求原硝酸的物质的量浓度。(假设反应前后溶液的体积不变)_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如图:

下列说法错误的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吹出塔进入吸收塔的物质为混合物
C.蒸馏塔中只发生了物理变化
D.经过吸收塔后,溴元素得到富集
查看答案和解析>>
科目: 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
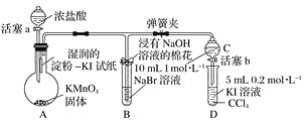
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是


A.过程①中钛氧键断裂会释放能量
B.CO2分解反应的热化学方程式为2CO2(g)=2CO(g)+O2(g)ΔH=+30kJ/mol
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.该反应中,光能和热能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com