
科目: 来源: 题型:
【题目】铁是人类比较早使用的金属之一。完成下列问题:
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:___________________________;
(2)滤液中存在较多的阳离子是____________________;
(3)以下试剂也可以替代氯气完成转化,最好选用的是________(填序号)。
a.酸性KMnO4溶液 b.溴水 c.H2O2 溶液
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:
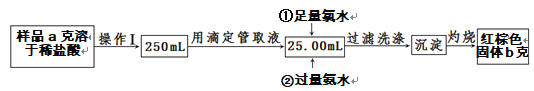
(4)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________________________(填仪器名称)。
(5)写出②加入过量氨水的离子方程式:_____________________。
(6)样品中铁元素的质量分数为________________。
(7)若沉淀灼烧不充分,对最终测量结果的影响:________________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O![]() [CuCl2],甲醛是具有强还原性的气体。
[CuCl2],甲醛是具有强还原性的气体。
下列说法正确的是
A.红色沉淀的主要成分不是Cu2O,可能是Cu
B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C.从甲醛的结构 ![]() 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(![]() ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D.含有-CHO的有机物都可以被新制Cu(OH)2氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 0.6 molB. 2.8 molC. 1.4 molD. 1.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是______________________________________;
溶液起相似作用的是______________________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
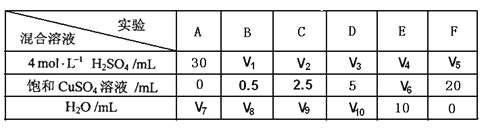
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量![]() 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的![]() 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4—CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g) C(s) +2H2(g) ΔH=+75 kJ·mol1;消碳反应:CO2(g) +C(s) 2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如下图。

下列说法正确的是
A.高压利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示实验装置制取乙酸乙酯。回答以下问题:
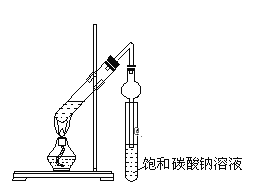
(1)在大试管中先加入3mL__,然后一边摇动一边慢慢地加入2mL___和2mL乙酸,混合均匀,然后加入几粒碎瓷片。按上图连好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是:____,_____。
(3)加热前,大试管中加入几粒碎瓷片的作用是___。
(4)乙酸乙酯的密度比水____(填“大”或“小”),有___气味。
(5)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:①____,②___。
(6)饱和碳酸钠溶液的作用是____、____、____。
查看答案和解析>>
科目: 来源: 题型:
【题目】处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3、ClO、CNO(C+4价,N-3价)、Cl等微粒。下列说法不正确的是

A.该废水呈强酸性
B.废水处理后转化为无害物质
C.反应的离子方程式:3ClO+2CNO+H2O == N2+2HCO3+3Cl
D.每处理1 mol CNO转移3 mol e
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com