
科目: 来源: 题型:
【题目】《神农本草经》记载,神农尝百草,日遇七十二毒,得茶而解。茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
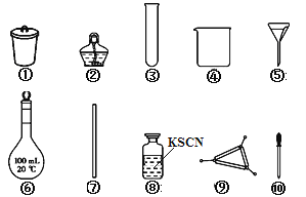
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 0.1mol氯气通入水中,转移电子的数目为0.1NA
B. 常温常压下,7.8g过氧化钠含有阴离子的数目为0.2NA
C. 标准状况下,22.4LCl2与足量的铁充分反应,转移电子数为3NA
D. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制造了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
⑴下列有关说法中,不正确的是________(填字母)。
A.O4分子内存在共价键
B.合成O4的反应可看做核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧元素的同素形体
D.O4将来可用作更强有力的火箭推进的氧化剂
⑵制备O2-、O22-甚至O22+的化合物是可能的,通常它们是在氧分子进行下图所示的各种反应时生成。这些反应中,相当于氧分子的氧化的是_______(填序号);相当于氧分子的还原的是_______(填序号)。

⑶O22+中氧原子间形成3对共用电子对使氧原子达到稳定结构,写出O22+的电子式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸镁是橡胶制品的优良填充剂及补强剂,补强效果优于碳酸钙及陶土,其折射率与天然橡胶相近,适于制造透明或半透明制品。碱式碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
回答下列问题:
(1)碱式碳酸镁中各元素的第一电离能由大到小的顺序为 _______________,写出一种与CO32-互为等电子体的常见微粒_______________,原子序数与CO32-的价电子数之和相等的基态原子的价电子排布式为________。
(2)碱式碳酸镁晶体生长液中生长的3种生长基元的结构如图所示:
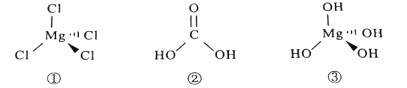
①(MgCl4)2-;②H2CO3;③[Mg(OH)4]2-
①和③中Mg原子的杂化方式为_______________,②中C原子的价电子对的几何分布形式为_______________。(MgCl4)2-中镁氯原子之间的距离R=0.25nm,则氯氯原子之间的距离为_______________(保留两位小数,已知![]() =2.45,cosl09°28'=
=2.45,cosl09°28'=![]() )。
)。
(3)碱式碳酸镁加热可分解生成MgO。已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构如图所示:

①请改正图中错误_______________(用文字表述)。
②在MgO晶体中,Mg2+的配位数为_______________,每个晶胞中所包含的Mg2+数目为_______________,每个Mg2+距离最近的且等距离的Mg2+数目为_______________。
③和某些离子化合物相比,MgO是一种优良的耐高温材料的内在原因为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
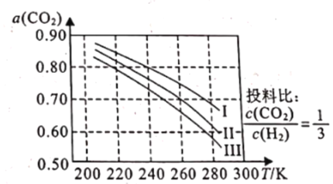
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________。[已知:Ksp[Ni(OH)2]=5×10-16]
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,列出8种元素在周期表中的位置。用化学用语回答下列问题:

⑴8种元素中,原子半径最小的是____,原子半径最大的是____,组成物质性质最稳定的是_____。
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:_________;
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是__________。
⑷元素⑧的氢化物的化学式为__________。该氢化物的主要用途:用作试剂、航空燃料。写出该氢化物在空气中燃烧的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用“锌”和“碳棒”作为导电材料,根据氧化还原反应H2SO4+Zn=ZnSO4+H2↑,设计如下原电池装置:
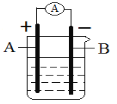
⑴该原电池电解质溶液中的溶质是________。
⑵电极A是________,该电极反应现象为_______。
⑶电极B是______,该电极反应现象为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.05molL-1的某稀酸H2B溶液中滴入0.1molL-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
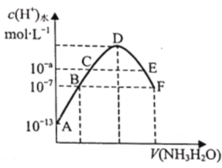
A.NaHB溶液中一定含有H2B分子
B.A、B、C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大
C.E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-)
D.B点溶液pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com