
科目: 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,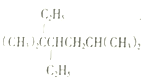 的名称为3,3,6一三甲基-4-乙基庚烷
的名称为3,3,6一三甲基-4-乙基庚烷
B. 已知C-C键可以绕键轴自由旋转,结构简式为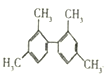 的分子中至少有11个碳原子处于同一平面上
的分子中至少有11个碳原子处于同一平面上
C. 苯中含有杂质苯酚,可用浓溴水来除杂
D. 1mol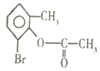 ,在一定条件下与足量NaOH溶液反应,最多消耗3molNaOH
,在一定条件下与足量NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G是一种神经类药物,其合成路线如下:
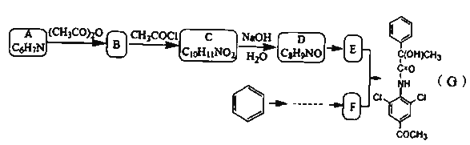
已知信息: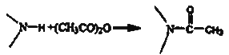 ;
;

![]()
(1)下列说法正确的是__________。
A.化合物G的分子式为![]()
B.化合物A到B的反应类型为取代反应
C.1mol化合物D最多可以与![]() 发生加成反应
发生加成反应
D.化合物D生成E的反应试剂和条件:浓氯水和铁屑
(2)A中官能团的名称是_________ C的结构简式:_________。
(3)写出E+F→G的化学方程式:__________________。
(4)写出化合物E同时符合下列条件的所有同分异构体的结构简式__________________。
①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基。
②分子中含有苯环,![]() 谱显示苯环上只有一种化学环境的氢原子。
谱显示苯环上只有一种化学环境的氢原子。
③苯环上有4个取代基,能发生银镜反应。
(5)根据题中信息,设计以苯和![]() 为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备己略)
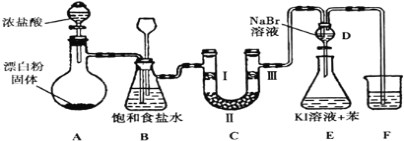
(1)装置A是氯气的发生装置,浓盐酸可与漂白粉的有效成分反应生成氯气。请写出相应反应的化学方程式:__________________________________;装置A部分用来装漂白粉的仪器名称是____________。
(2)装置B中饱和食盐水的作用是___________________________,同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞。请写出C中发生堵塞时B中的现象_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是___________(填字母编号).
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的验证氧化性强弱顺序:Cl2 >Br2 >I2。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_____________________,该现象______(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是________________。
(5)装置F的作用是___________,其烧杯中的溶液不能选用下列中的____________(填字母编号)。
a.饱和NaOH溶液 b.饱和NaCl溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中![]() 的的含量及有效地开发利用
的的含量及有效地开发利用![]() ,也正成为科学家研究的主要课题。利用
,也正成为科学家研究的主要课题。利用![]() 直接加氢合成二甲醚包括以下三个相互联系的反应。
直接加氢合成二甲醚包括以下三个相互联系的反应。
I甲醇的合成![]()
II甲醇脱水![]()
Ⅲ逆水汽变换![]()
已知:相关物质变化的焓变示意图如下:
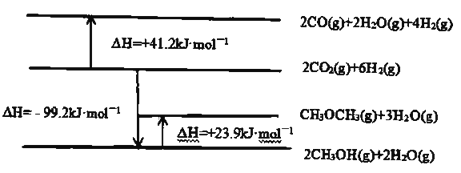
(1)请写出![]() 直接加氢合成二甲醚的热化学方程式:________________。
直接加氢合成二甲醚的热化学方程式:________________。
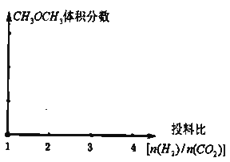
(2)保持恒温恒容的条件,当a充入![]() 、b充入
、b充入![]() ,在其他条件不变时,请在下图中分别画出平衡时
,在其他条件不变时,请在下图中分别画出平衡时![]() 的体积分数随投料比
的体积分数随投料比![]() 变化的曲线图,请用a、b标注曲线图。_________
变化的曲线图,请用a、b标注曲线图。_________
(3)在恒容密闭容器里按体积比为![]() 充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积分数增大
(4)温度、压强对反应中![]() 平衡转化率和二甲醚的选择性的影响如下图1,图2:
平衡转化率和二甲醚的选择性的影响如下图1,图2:
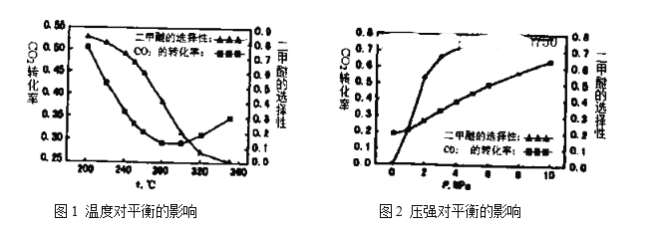
①根据图1,下列说法正确的是________。
A.温度较高时,反应以逆水汽变换反应为主,温度升高,反应速率加快,所以![]() 转化率增大
转化率增大
B.温度较低时,反应以合成二甲醚为主,正反应放热,升高温度,![]() 平衡转化率降低
平衡转化率降低
C.由图像可知,![]() 加氢合成二甲醚应该选择具有良好的低温活性的催化剂
加氢合成二甲醚应该选择具有良好的低温活性的催化剂
D.由图像可知,高温有利于逆水汽变换反应,而不利于二甲醚的生成
②根据图2可知:随着压强升高,![]() 平衡转化率和二甲醚的选择性都增大,分析原因:__________。
平衡转化率和二甲醚的选择性都增大,分析原因:__________。
(5)在![]() ,压强为3.0MPa的反应条件下,氢碳比
,压强为3.0MPa的反应条件下,氢碳比![]() 对
对![]() 转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
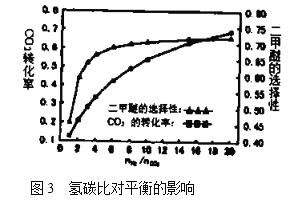
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:请回答下列问题:
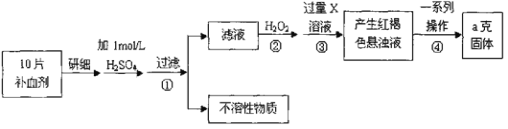
(1)实验中碾碎药片需要的仪器是_____________。
A.烧杯 B.研钵 C.坩埚
(2)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加____________,该过程的现象为:__________________________________________________________。
(3)步骤②加入过量H2O2的目的:________________________________________。
(4)步骤②③中反应的离子方程式:②________________、③_________________。
(5)步骤④中一系列处理的操作步骤:过滤、___、灼烧、____、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量_____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH为___,表示其中和热的热化学方程式为_______________。
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热为____kJ·mol-1,该反应的热化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性,则56g Fe参加反应时,被还原的HNO3为____g。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食中毒的事件,其原因是NaNO2外观和食盐相似,又有咸味,却可以把人体内的Fe2+转化为Fe3+而失去了与O2结合的能力。(已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。)根据上述反应,可判断NaNO2具有 __________性。鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式______Al+______NaNO3+______NaOH=______NaAlO2+______N2↑+______H2O;若反应过程中转移5mol电子,则生成标准状况下N2的体积为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.1mol钠蒸气与2mol钠蒸气完全燃烧时,燃烧热相同
B.燃烧热是反应热的种类之一
C.在稀溶液中:H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3kJ·mol1,若将含1molHNO3的稀溶液与含1molBa(OH)2的稀溶液混合,放出的热量为57.3kJ
H2O(l) ΔH=57.3kJ·mol1,若将含1molHNO3的稀溶液与含1molBa(OH)2的稀溶液混合,放出的热量为57.3kJ
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8kJ·mol1
2H2O(l) ΔH=+285.8kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是“铁链状”图案,图中相连的两物质可归属于同一类别,相交部分A、B、C、D为其相应的分类依据代号。
![]()
(1)①写出相邻两种物质之间能发生反应的化学方程式______________________________
②写出除去NaCl溶液中杂质FeCl3的化学方程式__________________________。
(2)请简述选用图中物质制备Fe(OH)3胶体的实验操作_________________________。
(3)以下框图中化合物A是上述链状图中的一种物质,是生活中常见的一种调味品,如下图是该物质在化工生产中的一系列反应;其中化合物F俗称烧碱,单质C也是上述链状图中的一种物质。
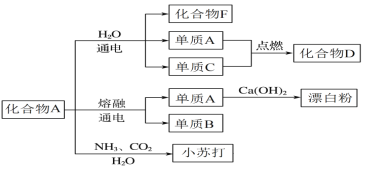
①写出单质B与H2O反应的离子方程式______________________________。
②单质A与Ca(OH)2反应制取漂白粉的化学方程式为 ________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
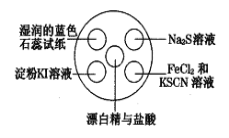
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com