
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性,则56g Fe参加反应时,被还原的HNO3为____g。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食中毒的事件,其原因是NaNO2外观和食盐相似,又有咸味,却可以把人体内的Fe2+转化为Fe3+而失去了与O2结合的能力。(已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。)根据上述反应,可判断NaNO2具有 __________性。鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式______Al+______NaNO3+______NaOH=______NaAlO2+______N2↑+______H2O;若反应过程中转移5mol电子,则生成标准状况下N2的体积为______。
【答案】酸、氧化 63 氧化 ①②⑤ B 10 6 4 10 3 2 11.2 L
【解析】
(1)由反应方程式可知硝酸中一部分生成盐,一部分价态降低生成![]() ,故硝酸表现了氧化性和酸性;
,故硝酸表现了氧化性和酸性;
(2)反应中![]() 元素的化合价降低,
元素的化合价降低,![]() 元素的化合价升高,由
元素的化合价升高,由![]() 可知,鉴别
可知,鉴别![]() 和
和![]() ,可利用碘的特 性分析;
,可利用碘的特 性分析;
(3)选择试剂时要考虑:既能使![]() 转化又无二次污染;
转化又无二次污染;
(4)![]() 元素的化合价由0升高为+3价,
元素的化合价由0升高为+3价,![]() 元素的化合价由+5价降低为0,由电子守恒及原子守恒分析;
元素的化合价由+5价降低为0,由电子守恒及原子守恒分析;
(1)由反应方程式可知硝酸中一部分生成![]() ,一部分价态降低生成
,一部分价态降低生成![]() ,故硝酸表现了氧化性和酸性;
,故硝酸表现了氧化性和酸性;
(2)反应中![]() 元素的化合价降低,
元素的化合价降低,![]() 元素的化合价升高,则还原剂为
元素的化合价升高,则还原剂为![]() ,氧化剂为
,氧化剂为![]() ,具有氧化性,由
,具有氧化性,由![]() 可知,根据题中反应,
可知,根据题中反应,![]() 在酸性溶液中,能将
在酸性溶液中,能将![]() 氧化成
氧化成 ![]() ,淀粉遇
,淀粉遇![]() 变蓝色,则选择①碘化钾淀粉试纸,⑤食醋,变蓝的为
变蓝色,则选择①碘化钾淀粉试纸,⑤食醋,变蓝的为![]() , 故答案为:①②⑤;
, 故答案为:①②⑤;
(3)![]() →
→![]() 是被还原,必须加还原剂,N元素氧化性弱于O和C元素,故只能加
是被还原,必须加还原剂,N元素氧化性弱于O和C元素,故只能加![]() 作还原剂。方程式为
作还原剂。方程式为 ![]() ,故答案为:B;
,故答案为:B;
(4)![]() 元素的化合价由0升高为+3价,
元素的化合价由0升高为+3价,![]() 元素的化合价由+5价降低为0,该反应还
元素的化合价由+5价降低为0,该反应还![]() ,过程中转移10mol
,过程中转移10mol![]() ,则转移5mol
,则转移5mol![]() 生成标准状况下
生成标准状况下![]() 的体积为 1/2×22.4L/mol=11.2L, 故答案为:10,6,4,10,3,2;11.2L。
的体积为 1/2×22.4L/mol=11.2L, 故答案为:10,6,4,10,3,2;11.2L。


科目:高中化学 来源: 题型:
【题目】某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3·![]() H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。
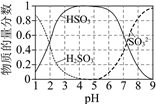
Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e,同时生成1 mol O2。
(1)SO2造成的环境问题主要是_____________________。
(2)ZnO将SO2转化为ZnSO3·![]() H2O的化学方程式是_____________________________。
H2O的化学方程式是_____________________________。
(3)将ZnSO3·![]() H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·
H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·![]() H2O,其中溶液pH随时间变化的曲线如下:
H2O,其中溶液pH随时间变化的曲线如下:

①pH=3.5的溶液中含S(+4价)的离子主要是____________________。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是________________。
③解释O3氧化可防止管道堵塞的原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.CO2通入饱和碳酸钠溶液中:CO2 +CO32- + H2O=2HCO3-
B.明矾溶液中加氢氧化钡至硫酸根恰好沉淀完全:Al3+ + 2SO42- + 2Ba2+ + 4OH- == 2BaSO4↓ + AlO2- + 2H2O
C.钠和冷水反应Na+ 2H2O =Na+ + 2OH- + H2↑
D.氯化铝溶液中加入过量的氨水Al3+ + 4NH3·H2O =AlO2- + 4NH4+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol(反应热)
SO2(g) ΔH=269.8kJ/mol(反应热)
D.Fe+S![]() FeS ΔH=95.6kJ/mol(反应热)
FeS ΔH=95.6kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种神经类药物,其合成路线如下:
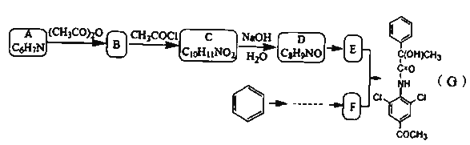
已知信息: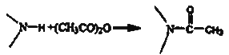 ;
;

![]()
(1)下列说法正确的是__________。
A.化合物G的分子式为![]()
B.化合物A到B的反应类型为取代反应
C.1mol化合物D最多可以与![]() 发生加成反应
发生加成反应
D.化合物D生成E的反应试剂和条件:浓氯水和铁屑
(2)A中官能团的名称是_________ C的结构简式:_________。
(3)写出E+F→G的化学方程式:__________________。
(4)写出化合物E同时符合下列条件的所有同分异构体的结构简式__________________。
①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基。
②分子中含有苯环,![]() 谱显示苯环上只有一种化学环境的氢原子。
谱显示苯环上只有一种化学环境的氢原子。
③苯环上有4个取代基,能发生银镜反应。
(5)根据题中信息,设计以苯和![]() 为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制0.500 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、__________、_______.
(2)本实验须称量碳酸钠晶体(Na2CO310H2O)________g。
(3)①如果定容时仰视会导致溶液浓度__________(填“偏高”、“偏低”或“无影响” 下同);
②容量瓶未经干燥就用来配制该溶液,会导致溶液浓度_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知: ,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
II.叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
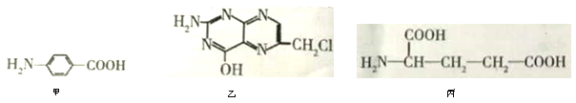
(1)甲中显酸性的官能团是______________(填名称)。
(2)下列关于乙的说法正确的是__________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,了的结构简式为______________.
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com