
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(![]() )中含有的共价键数为0. 3 NA
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】双安妥明可用于降低血糖中的胆固醇.其结构简式为: 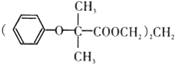
该物质的合成路线如图所示:
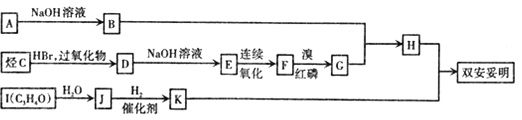
已知:I. 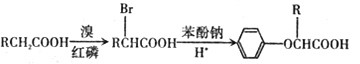
II.RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
III.C的密度是同温同压下氢气密度的28 倍.且支链有一个甲基;I 能发生银镜反应且1 molI能与 2molH2 发生加成反应;K 的结构具有对称性。
请回答下列问题:
(1)A的结构简式为 ___________,J中所含官能团名称为_________。
(2)D的名称为__________ 。
(3)反应D→E的化学方程式为 ___________,其反应类型是__________。
(4)“H+K→双安妥明”的化学方程式为 ___________。
(5)L为比H的相对分子质量小14的同系物.其中满足①苯环上有两个取代基,② 苯环上一氯代物只有两种,③能与FeCl3溶液发生显色反应.且属于酯的L有_______种 。
查看答案和解析>>
科目: 来源: 题型:
【题目】按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
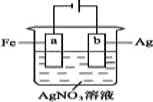

①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A. ①③B. ③④C. ①②④D. ①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
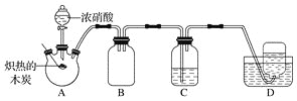
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如图:
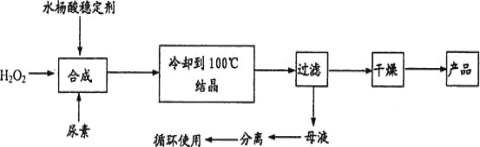
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,其主要原因是____。
(2)从母液中分离出H2O2和尿素,采用的操作是____。
a.盐析、过滤 b.分液、过滤 c.减压蒸馏、结晶 d.常压蒸馏、萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①滴定终点的现象是:滴入最后一滴KMnO4溶液后____。
②容量瓶在使用前必须进行的操作是____。
③完成并配平方程式:__MnO4-+___H2O2+___H+=___Mn2++____H2O+____,__
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___(选填:“偏高”、“偏低”或“不变”)。
⑤根据滴定结果,确定产品中活性氧的质量分数__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂 、显影液等。 某化学兴趣小组对(NH4)2Cr2O7 的部分性质及组成进行探究 。已知 :Cr2O72-(橙色)+H2O22 CrO42- (黄色)+2H+。 请回答下列问题
(1)向盛有少量(NH4)2Cr2O7 固体的试管中.滴加足量浓KOH溶液.振荡、微热 ,观察到的实验现象有_______________ 。
(2) 为探究(NH4)2Cr2O7 (摩尔质量为 252g/mol)的分解产物 .按下图连接好装置,在A中加入5.040 g 样品进行实验 。
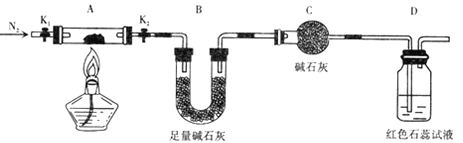
①仪器C的名称是____________ 。
②连接好装置后需进行的必要橾作是 ________,点燃酒精灯之前需进行的必要橾作是
___________________________。
③反应结束后.依然要通一段时间氮气的原因是 ____________________ .
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为 Cr2O3 ,B中质量变化为1.44g. 写出( NH4)2Cr2O7加热分解的化学方程式:____________。
(3)实验室常用甲醛法测定含( NH4)2Cr2O7 的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++ Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ 滴定时 l mol(CH2)6N4H+ 与 l mol H+ 相当].然后用 NaOH标准溶液滴定 反应生成的酸。
实验步骤:称取品8.400g. 配成500mL溶液,移取25.00mL, 样品溶液于250mL锥形瓶中.用氯化钡溶液使Cr2O72- 完全沉淀后加入15.00mL2 0.00molL-1的中性甲醛溶液,摇 匀、静置5min 后,加入1- 2 滴酚酞试液 ,用0 .2000molL-1 NaOH标准溶液滴定至终点。重复上述操作 3次,最终滴定用去NaOH 标准溶液体积的平均值为 30.00mL。
①若滴定终点时,仰视读数。则测定结果 ____(填 “偏大”“偏小”或“无影响 ”)。
②样品中氮的质量分数为 _____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
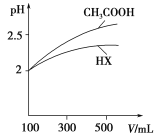
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
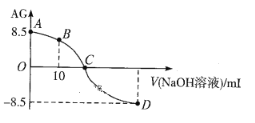
A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
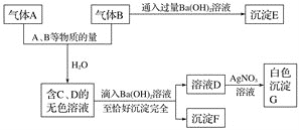
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com