
科目: 来源: 题型:
【题目】在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6 mol·L-1HCl 100 mL,使天平达到平衡。分别向两烧杯中加入不超过5 g 的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为( )
A. 1∶1 B. 24∶27 C. 12∶9 D. 32∶33
查看答案和解析>>
科目: 来源: 题型:
【题目】探究FeSO4的热分解产物的实验装置如图所示,乙和丙中盛有检验相应物质的常用试剂,实验完成后甲中残留固体为红棕色。下列有关实验操作或现象的叙述正确的是( )

A.实验过程中持续通氮气的目的是排除装置内空气
B.用盐酸和K3[Fe(CN)6]溶液检验残留固体的主要成分
C.乙装置中生成白色沉淀、丙装置中溶液褪色
D.丁装置中所盛装的试剂可用澄清石灰水替代
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中A是气体单质,根据下图所示的A、B、C、D、E五种物质的相互转化关系,完成以下各题。
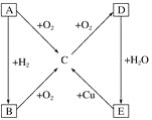
(1)分别写出下列物质的化学式
A______,B______,C______,D______,E______。
(2)写出有关反应的化学方程式:____________________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是( )
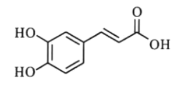
A.分子式为C9H8O4
B.分子中所有原子可能处于同一平面
C.1mol该分子最多可与5molH2发生加成反应
D.能与NaHCO3溶液反应放出CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
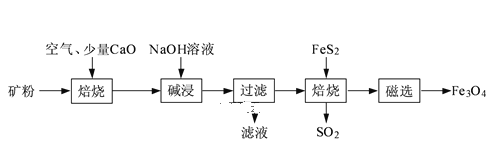
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为____。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
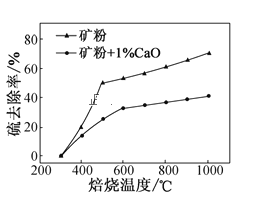
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于____。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由___(填化学式)转化为____(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
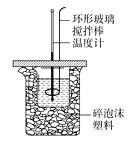
(1)大小烧杯间填满碎泡沫塑料的作用是_____。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将____(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60mL0.50 mol·L-1盐酸与50mL0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),简述理由___。
(4)若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图:
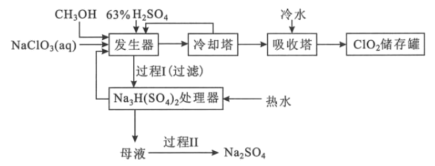
回答下列问题:
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。
(2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。
(3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。
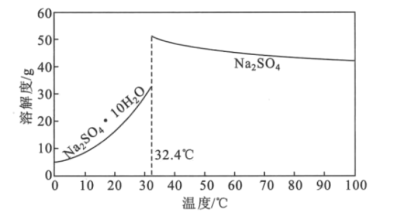
(4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。
(5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。
(6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com