
科目: 来源: 题型:
【题目】实验室要配制0.40mol·L-1 Na2CO3溶液100mL。
⑴请将配制该溶液的实验步骤补充完整。
①计算,需Na2CO3固体的质量为__________g;
②把称量好的Na2CO3固体倒入小烧杯中,加入适量的蒸馏水溶解、冷却至室温;
③把②所得溶液小心引流到100mL容量瓶中;
④继续向容量瓶中加蒸馏水至液面接近容量瓶的刻度线1~2cm处,改用胶头滴管滴加蒸馏水至______________________________________________;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒_________次,并将每次洗涤的溶液都注入容量瓶,轻轻摇匀;
⑥将容量瓶的瓶塞盖好,反复上下颠倒、摇匀。
⑵容量瓶使用前需____________________________________。
⑶配制该溶液的正确顺序是______________________________(填序号)。
⑷若出现如下情况,其中将引起所配溶液浓度偏低的是__________(填序号)。
①未洗涤烧杯内壁和玻璃棒
②定容时,俯视容量瓶的刻度线
③转移前,容量瓶中含有少量蒸馏水
④加水定容时不慎超过了刻度线,再用胶头滴管吸出多余的液体
⑸上述配制好的溶液导入试剂瓶后需贴上标签,请你填写如图标签的内容_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】铬、钼![]() 、钨
、钨![]() 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
![]() 铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
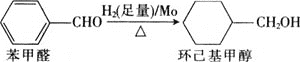
![]() 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
![]() 环己基甲醇分子中采取
环己基甲醇分子中采取![]() 杂化的原子是________
杂化的原子是________![]() 写元素符号
写元素符号![]() 。
。
![]() 环己基甲醇的沸点高于苯甲醛,其原因是________。
环己基甲醇的沸点高于苯甲醛,其原因是________。
![]() 铬离子
铬离子![]() 能形成多种配合物,例如
能形成多种配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,![]() 的配位数为________。
的配位数为________。
![]() 上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
![]() 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
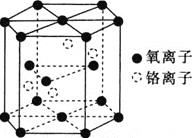
![]() 该氧化物的化学式为________。
该氧化物的化学式为________。
![]() 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm,![]() 代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为![]() 。该晶体的密度为________
。该晶体的密度为________![]() 用含a、b、
用含a、b、![]() 和M的代数式表示
和M的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
查看答案和解析>>
科目: 来源: 题型:
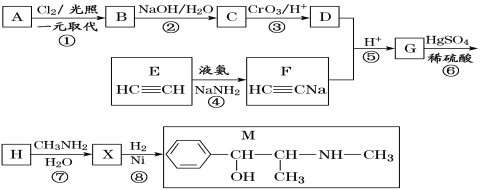
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
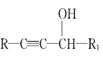
IV.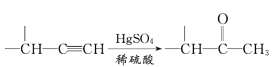
V.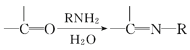
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |

①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,Ka的值增大
B. 升高温度,Ka的值增大
C. 向醋酸溶液中加水,Ka的值增大
D. 向醋酸溶液中加氢氧化钠溶液,Ka的值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有六种物质:①Cl2 ②CaO ③Na2CO3溶液 ④蔗糖 ⑤BaCl2晶体 ⑥CO2
⑴属于电解质的是__________________(填序号,下同);属于非电解质的是_________。
⑵属于碱性氧化物的是_________________。
⑶写出⑤溶于水的电离方程式__________________________________。
⑷写出③与⑥反应的化学方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;H2CO3
H++SO32-;H2CO3![]() H++HCO3-;HCO3-
H++HCO3-;HCO3-![]() H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
H++CO32-;电离平衡常数分别为K1、K′1、K2、K′2,已知K1>K′1≈K2>K′2,则溶液中不可以大量共存的离子组是 ( )
A. SO32-、HCO3-B. HSO3-、CO32-C. SO32-、CO32-D. HSO3-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A. ①② B. ②④ C. ③④ D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com