
科目: 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )
A. ![]() mol/LB.
mol/LB. ![]() mol/LC.
mol/LC. ![]() mol/LD.
mol/LD. ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )

A. 闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质
B. 闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化
C. 闭合开关K,向溶液中加入CaCO3固体,电流计示数不变
D. 选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
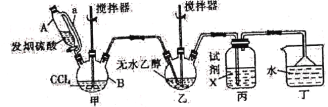
回答下列问题:
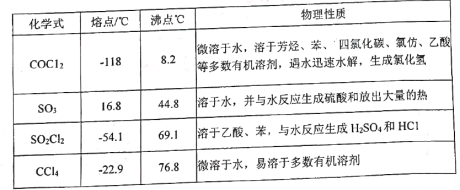
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是____________。②仪器A的侧导管a的作用是______________________。
(2)试剂X是____________,其作用是_____________________________________________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是____________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:________________________________________________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________________________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是______(三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
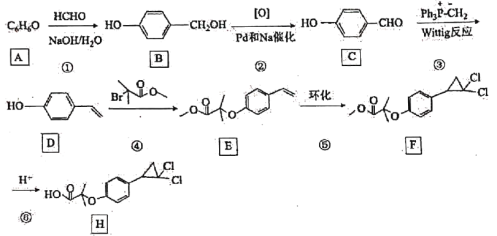
回答下列问题:
(1)B的化学名称为___________。
(2)F中非含氧官能团的名称为___________。
(3)反应①的反应类型为___________,反应④的化学方程式为_______________________。
(4)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
(5)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:____________________________________________。
的合成路线:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】催化剂在现代化学工业中占有极其重要的地位,主要涉及过渡元素及其化合物、硅、铝化合物等。中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。
(1)硅、碳位于同一主族,用“>”“<”或“=”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 | ①Si__________C | ②C_________Si | ③CO2______SiO2 | ④H-Si_______H-C |
(2)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有_____________(任写一种);1mol[Fe(CN)6]3-中含____________mol σ键。
(3)已知:反应2CH4![]() CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
(4)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(5)基态F原子的价层电子排布图为___________。
(6)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为____________。
(7)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
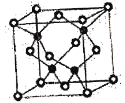
①CuF的熔点比CuCl的高,原因是____________________________________________。
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图所示,则CuF的晶胞参数a=__________nm(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

物质 | 燃烧热/(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应,器中充入1 mol CH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:

①在该温度下,其平衡常数KC=____________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率____________。(填“增大”“减小”“不变”或“无法确定”),理由是_______________________________。
③若反应器的体积固定,不同压强下可得变化如右图所示,则压强P1,P2的大小关系是____________。

(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示800℃时A、B、C三种气体的物质的量浓度随时间变化的情况,t时各组分浓度不再变化。试回答:

(1)该反应的反应物是_____,达平衡时其转化率是___。
(2)该反应的化学方程式是______。
(3)若t是2min,A物质的平均反应速率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:

N2(g)和O2(g)生成NO(g)过程中的能量变化
①人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ/mol。
②由上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:___________________________
(2)①已知:C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6kJ/mol
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol,
则由C(石墨,s)和H2(g)反应生成1mol C2H2(g)时ΔH=________kJ/mol。
②火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com