
【题目】如图表示800℃时A、B、C三种气体的物质的量浓度随时间变化的情况,t时各组分浓度不再变化。试回答:

(1)该反应的反应物是_____,达平衡时其转化率是___。
(2)该反应的化学方程式是______。
(3)若t是2min,A物质的平均反应速率是______。
【答案】A 50% 3A![]() B+3C 0.6mol·L-1·min-1
B+3C 0.6mol·L-1·min-1
【解析】
在反应过程中减少的物质是反应物,增加的物质是生成物,根据物质浓度变化量的比等于化学方程式的计量数的比书写反应方程式,结合物质的转化率、化学反应速率的含义进行计算。
(1)由图可知,随着反应的进行,A的浓度降低,A为反应物,B、C的浓度增大, B、C为生成物;从开始到达到平衡时,A的浓度变化了△c(A)=2.4mol/L-1.2mol/L,则物质A的转化率=![]() ×100%==50%;
×100%==50%;
(2)由图可知,△c(A)=2.4mol/L-1.2mol/L=1.2mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为1.2mol/L:0.4mol/L:1.2mol/L=3:1:3,该反应进行到tmin后各种物质的浓度不再变化,说明反应为可逆反应,故反应方程式为3A![]() B+3C;
B+3C;
(3)由图可知在2min内,A物质的浓度变化量为△c(A)=2.4mol/L-1.2mol/L=1.2mol/L,,所v(A)=![]() =0.6mol·L-1·min-1。
=0.6mol·L-1·min-1。


科目:高中化学 来源: 题型:
【题目】锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2] n等用途非常广泛。
(1)Zn2+基态核外电子排布式为________________________。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。

(3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:

①与CN-互为等电子体的分子是____________(填化学式,写两种)。
②2-甲基咪唑中碳原子杂化轨道类型为________;1 mol 2-甲基咪唑分子中含σ键和π键之比为________。
③乙二胺易溶于水的主要原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学方法以SO2和Na2SO3为原料制取硫酸的装置如图所示(A、B为多孔石墨电极,C、D为惰性电极)。下列说法错误的是( )

A.“膜2”为阳离子交换膜
B.电极A的电极反应为SO2-2e-+2H2O==SO42-+4H+
C.上述过程中,亚硫酸钠溶液可循环使用
D.使用该装置制取98g硫酸需消耗11.2L O2(STP)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)===2H2O(g) ΔH=-483.6kJ/mol;
②H2(g)+S(g)===H2S(g) ΔH=-20.1kJ/mol。下列判断一定正确的是( )
A. 由①、②知,2H2S(g)+O2(g)===2S(g)+2H2O(g) ΔH=-443.4kJ/mol
B. 由①知,氢气的燃烧热为241.8kJ
C. 反应②中的能量变化可用如图表示
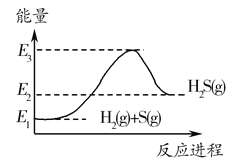
D. 若反应②中改用固态硫,则放热大于20.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3:2
B.X的分子式为C11H14O5
C.由X制取Y的过程中可得到甲醇
D.一定条件下,Y能发生氧化反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
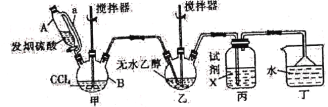
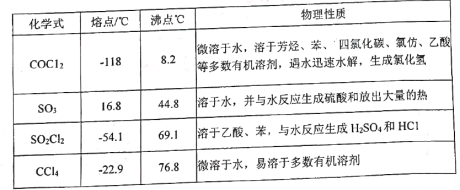
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是____________。②仪器A的侧导管a的作用是______________________。
(2)试剂X是____________,其作用是_____________________________________________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是____________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:________________________________________________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________________________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是______(三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A. 充分反应后,放出热量为a kJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又称抗坏血酸,能增强对传染病的抵抗力,有解毒作用等,其结构式为 ,下列有关说法错误的是
,下列有关说法错误的是
A.维生素C分子式为C6H8O6
B.维生素C的同分异构体中可能有芳香族化合物
C.向维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C溶液显酸性
D.在一定条件下,维生素C能发生氧化反应、加成反应、取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com