
科目: 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。下列判断不正确的是( )
Cr2O72-+H2O。下列判断不正确的是( )
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③中溶液颜色变化是由化学平衡移动引起的
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置于低温处
B.对2HI(g) ![]() H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
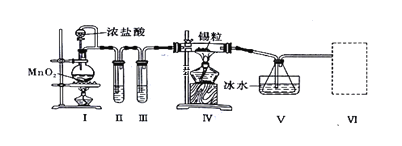
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是________________________________________
(2)试管II中的试剂是________,试管III中的试剂是____________。
(3)装置V的作用是____________。
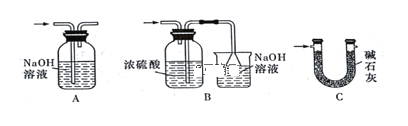
(4)裝置Ⅵ 最好选用下列装置中的________(填标号)。
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是元素的摇篮,海水中含有大量卤族元素。NaCl晶胞结构示意图如下所示(晶胞边长为a nm).

(1)元素 Na的价电子被激发到相邻高能级后形成的激发态Na原子,其价电子轨道表示式为__________。
(2)除了 NaCl,Cl 元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:__________。
(3)在适当条件下,电解NaCl水溶液可制得 NaClO3。
①NaCl水溶液中存在的微粒间作用力有________(填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
②根据价层电子对互斥理论,预测ClO3-的空间构型为________,写出一个ClO3-的等电子体的化学符号:______________
(4)在NaCl晶体中,Na 位于Cl 所围成的正______面体的体心,该多面体的边长是______nm。
(5)Na 半径与Cl半径的比值为______(保留小数点后3位,![]() =1.414)。
=1.414)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是___________.
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸、②淀粉、③白酒、④食醋,你认为必须选用的物质有__________(填序号).
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号).
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平化学方程式:___Al+___NaNO3+___NaOH═___NaAlO2+___N2↑+___H2O.
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
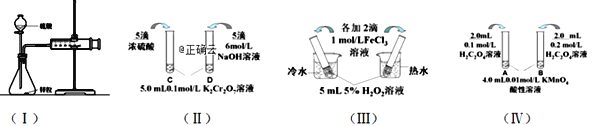
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):______________________。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
(3)实验(Ⅲ)中实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如下表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.0×10-7 Ka2=7.1×10-15 |
请回答下列问题:
(1)若把CH3COOH、H2C2O4、HC2O4-、H2S、HS- 都看作是酸,其中酸性最弱的是________。
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序为_____________________。
(3)NaHS溶液与NaHC2O4溶液反应的离子方程式为_______________。
(4)0.1 mol·L-1H2S溶液中c(H+)=________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇(HOCH2CH2OH)的总热化学方程式:________________________________________,该反应在较低温条件下能自发进行,则ΔH______0 (填“>”、“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. 混合气体总物质的量不再变化
b. 混合气体的密度不再变化
c. 单位时间内生成 CO 和 NO 的物质的量相等
d. CO 和 CH3ONO 的浓度比不再变化
②若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
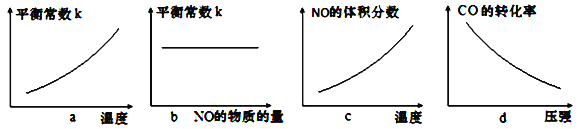
④反应达平衡后向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,化学平衡向________(填“正反应”、“逆反应”或“平衡不移动”)方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面所列物质中,属于电解质的是__________(填序号,下同),属于非电解质的是________,属于强电解质的是__________,属于弱电解质的是________。
①CH3CH2OH ②CH3COOH ③熔融态KNO3 ④SO3 ⑤蔗糖 ⑥HClO ⑦NaHCO3 ⑧氨水 ⑨Cl2 ⑩BaSO4 Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com