
科目: 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.氯气溶于水:H2O+Cl2= 2H++ Cl-+ClO-
C.锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+
D.向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列条件的溶液中,各组离子一定能够大量共存的是( )
A.使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.无色透明溶液中:K+、SO42-、MnO4-、H+
C.含有大量OH-的溶液中:Ba2+、Na+、NO3-、Cl-
D.可与锌反应放出氢气的溶液中:Na+、Ca2+、Cl-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。
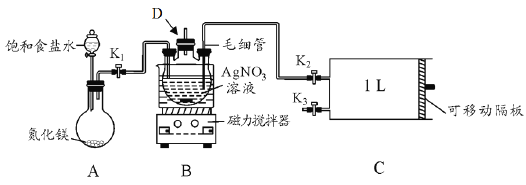
I.配制银氨溶液
(1)盛装AgNO3溶液的仪器D的名称_________。
(2)关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式____;饱和食盐水的用途是_______。
(3)已知银氨溶液的成分是Ag(NH3)2OH,写出D中生成银氨溶液的化学方程式_________ 。
II.测定室内空气中甲醛含量
(4)用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是___________。共计进行上述操作十次。
(5)装置中毛细管的作用是_____________ 。
(6)已知甲醛被银氨溶液氧化的化学方程式为HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为________mg L-1(空气中其它物质不与银氨溶液反应)。
(7)该设计装置存在一个明显的不足之处是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的
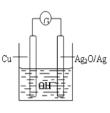
A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目: 来源: 题型:
【题目】I.向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。
(1)H2O和NH3分子中心原子的杂化类型分别为_______、______。分子中的键角:H2O_______NH3填(“大于”或“小于’)。原因是______。
(2)通过上述实验现象可知,与Cu2+的配位能力:H2O___ NH3(填“大于”或“小于”)。
II.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。基态氟原子的价电子排布图为______;
(2)①已知:(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____。
a.离子键 b.共价键 c.配位键 d.金属键
② CO32-的空间构型______ ,写出它的等电子体的化学式(分子、离子各写一种____ 、____ 。
(3)UO2的晶胞结构如下图所示:
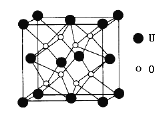
①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为_______(填“立方体”、“四面体、“八面体”);
②若两个氧原子间的最短距离为a nm,则UD2晶体的密度为______g·cm-3。(列出含a计算式即可。用NA表示阿伏加德罗常数的值。)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
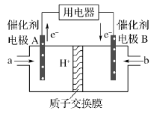
A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol Fe与足量氯气反应时,转移的电子数目为0.2NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
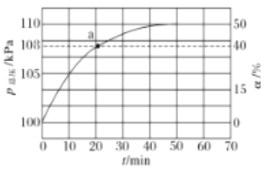
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的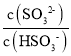 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com