
科目: 来源: 题型:
【题目】实验室用浓盐酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 为原料进行实验,装置如下图所示。
为原料进行实验,装置如下图所示。
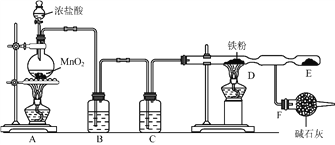
⑴装置![]() 烧瓶中发生反应的化学方程式为:_________________________________。
烧瓶中发生反应的化学方程式为:_________________________________。
⑵装置![]() 、
、![]() 中应盛放的试剂名称分别为__________、_________;从
中应盛放的试剂名称分别为__________、_________;从![]() 装置导出的气体若不经过
装置导出的气体若不经过![]() 、
、![]() 装置而直接进入
装置而直接进入![]() 管,将对实验产生的不良后果是___________________________。
管,将对实验产生的不良后果是___________________________。
⑶实验时,先点燃![]() 处的酒精灯,让氯气充满装置,再点燃
处的酒精灯,让氯气充满装置,再点燃![]() 处酒精灯,写出
处酒精灯,写出![]() 中反应的化学方程式:_________________________________________。
中反应的化学方程式:_________________________________________。
⑷![]() 装置所起的作用是____________________,____________________。
装置所起的作用是____________________,____________________。
⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“生活无处不化学”,请你回答下列问题。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。主要成分中具有碱性的是_____(填序号,下同);属于盐类的是______;相互间能发生反应的是________。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是_______________,该变化称为______反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是__________________。
(4)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。
“消毒液”与“洁厕灵”同时使用会产生有毒的氯气,写出该反应的离子方程式:____________________________________________。
(5)纯碱(Na2CO3)、小苏打(NaHCO3)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程中,小苏打发生分解反应,该反应的化学方程式是_____________________________________;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的离子方程式是__________________________________________。
(6)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化图如下图,下列说法正确的是:

A. 单斜硫没有正交硫稳定
B. S(s,单斜)=S(s,正交) △H=+0.33 kJ· mol-1
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂l mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用下图装置探究石蜡油分解产物的性质,下列说法错误的是
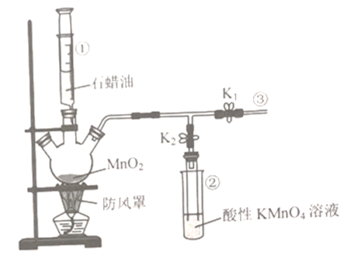
A.仪器①可控制石蜡油滴加的速率
B.装置②起到防倒吸的作用
C.实验过程中,关闭K1,打开K2,装置②中溶液颜色逐渐褪去
D.加热一段时间后,关闭K2,打开K1,在③处点燃气体可看到淡蓝色火焰
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
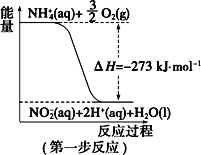
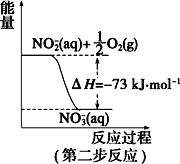
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
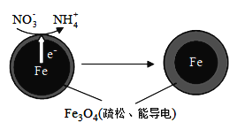
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为___________,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应式_________;

(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________。
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________。
(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:________________。
②乙装置中石墨电极产生产物如何检验______,电解一段时间后,乙池中的溶液呈___性。
③图中用丙装置模拟工业中的________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于__________变化(填“物理”或“化学”);稳定性白磷_________红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知1g氢气燃烧生成气态水放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热__。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:
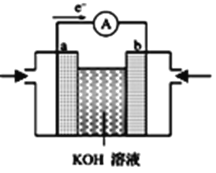
①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②放电时,b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,总反应为:CH4+ 2O2 + 2OH- = CO32- + 3H2O,则负极电极反应式为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把Na2CO3和NaHCO3的混合物27.4g加热到质量不再变化时,得残留固体21.2g。求原混合物中NaHCO3和Na2CO3的质量之比为( )
A.53∶84B.1∶1C.84∶53D.42∶53
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com