
科目: 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2A(g)+B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol·(L·min) -1B. v (B)=0.2 mol·(L·min) -1
C. v (C)=0.3 mol·(L·min) -1D. v (D)=0.1 mol·(L·min) -1
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表及前20号元素W、X、Y、Z、Q能形成一种常用的净水剂。各元素的原子半径与最外层电子数的关系如图所示,Q为前20号元素中原子半径最大的元素,QW为离子化合物.下列叙述错误的是
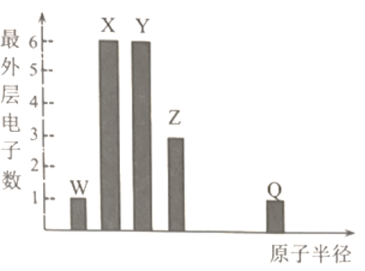
A.灼烧QW,透过蓝色钴玻璃观察焰色为紫色
B.X的氢化物中只含有极性共价键
C.X和Y分别和W形成的简单化合物,前者更稳定
D.Y和Q的最高价氧化物水化物的水溶液均能溶解X与Z形成的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是

A.充电时阳极的电极反应式为3I--2e-=I3-
B.放电时,a极发生氧化反应
C.放电时,正、负极反应的微粒数目比为4:3
D.辅助充电时,光能转化为电能,再转化为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关钠及其化合物的有关说法中正确的是( )
A.钠与CuSO4溶液反应的离子方程式为2Na+Cu2+═Cu+2Na+
B.7.8 g Na2O2含离子数为0.4NA
C.“侯氏制碱法”中的碱指NaHCO3
D.向Na2CO3饱和溶液中通入足量的CO2,有NaHCO3结晶析出
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代许多著作在化学学科知识上都体现出了一定水平的认识。其中《管子地数》中有记载:“上有丹沙者,下有黄金;上有慈石者,下有铜金。”
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是_____;(填化学式)“慈石者磁石也”,请写出磁石溶于盐酸的离子方程式:_____;
Ⅱ.“铜金者,斑岩铜矿也。”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO47H2O)。其主要流程如图:
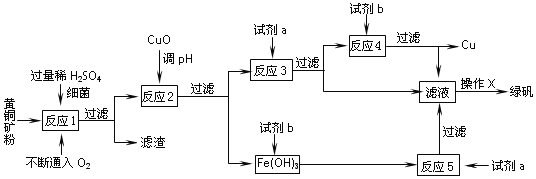
已知:①“反应1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)“反应1”中,每生成1 mol CuSO4转移电子数为_____NA;
(2)“试剂a”是_____,“试剂b”是_____;
(3)“反应2”中加CuO调pH为3.7~4.7的目的是_____;
(4)“操作X”应为_____、_____、过滤、洗涤;请简述上述“操作X”中如何对所得 FeSO47H2O晶体进行洗涤_____;
(5)简述如何判断“反应5”已进行完全:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】计算下列各题:
(1)在标准状况下,CO和CO2的混合气体共17.92L,质量为27.2g,则两种气体的物质的量之和为________ mol,其中CO2为________ mol,CO占总体积的________,混合气体的摩尔质量为________。
(2)在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO在标准状况下的体积为
_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com