
科目: 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是
A. c(H+)随温度的升高而降低B. 在35℃时,c(H+)>c(OH-)
C. 水的电离度α(25℃)>α(35℃)D. 水的电离是吸热的
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是几种常见弱酸的电离平衡常数(25℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 |
HCO | K2=4.7×10-11 | |
H2S | H2S | K1=1.3×10-7 |
HS- | K2=7.1×10-15 | |
H3PO4 | H3PO4 | K1=7.1×10-3 |
H2PO4- | K2=6.3×10-8 | |
HPO42- | K3=4.2×10-13 |
(1) 当温度升高时,K值_____(填“增大”“减小”或“不变”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是_____,最弱的是_____。由离子反应规律及上述数据判断,下列各组物质在溶液中混合后能发生反应的有_____(填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由_______决定。假设某氢硫酸溶液的浓度为0.001 3 mol·L-1,则溶液中c(H+)=______。
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是____,反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I. 脱硝:
已知:H2的燃烧热为285.8kJ·mol1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol1
H2O(g)=H2O(l) ΔH=44kJ·mol1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:______。
II. 脱碳:
(1)向2L密闭容器中加入2mol CO2和6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
① 该反应自发进行的条件是_____(填“低温”、“高温”或“任意温度”)
② 下列叙述能说明此反应达到平衡状态的是_____。(填字母)
a. 混合气体的平均式量保持不变 b. CO2和H2的体积分数保持不变 c. CO2和H2的转化率相等
d. 混合气体的密度保持不变 e. 1 mol CO2生成的同时有3 mol HH键断裂
(2) 改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I)___K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I)___c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)=_____。在其他条件不变的情况下,若30 min时只改变温度T2℃,此时H2的物质的量为3.2 mol,则T1____T2(填“>”、“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决大气中CO2的含量增大的问题,某科学家提出把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,再转变为燃料甲醇的“绿色自由”构想,其部分技术流程如图:
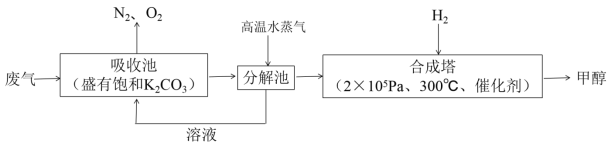
(1) 吸收池中主要反应的离子方程式为____
(2) 合成塔中合成1molCH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为____;工业上CO也可用于合成甲醇,已知:2CO(g)+O2(g)=2CO2(g) ΔH2;2H2(g)+O2(g)=2H2O(g) ΔH3;则CO(g)+2H2(g)=CH3OH(g) ΔH4=____(用ΔH1、ΔH2、ΔH3表示)。
(3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g)![]() CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
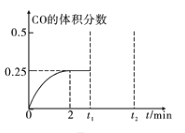
① 反应达到平衡状态的标志是____(填序号)。
A. 气体的密度保持不变
B. 气体的平均摩尔质量保持不变
C . 2v正(H2)=v逆(CO)
D. c(CH3OH):c(CO):c(H2)=1:1:2的时候
E. 气体的体积分数保持不变
② 在该温度下,此反应的化学平衡常数K=______,若在t1时刻再加入1mol CH3OH(g),在t2时刻重新达到平衡,则在t2时刻CO的体积分数____0.25(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】饱和氯水中存在平衡:Cl2+H2O![]() H++Cl-+HClO,下列说法错误的是( )
H++Cl-+HClO,下列说法错误的是( )
A.向该氯水中通入Cl2,平衡向右移动
B.向该氯水中通入少量SO2溶液的pH减小
C.向该氯水中加入CaCO3粉末,c(HClO)增大
D.升高温度,c(Cl2)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
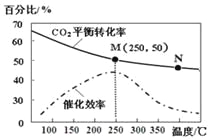
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
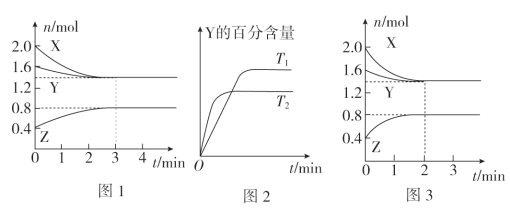
A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g ZnD. 反应中共转移3 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com