
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
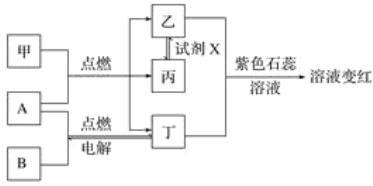
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应X+Y=M+N的能量变化关系如图。下列关于该反应的说法中,正确的是( )
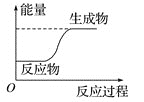
A.断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量
B.X、Y的总能量一定低于M、N的总能量
C.因为该反应为吸热反应,故一定要加热才可发生
D.X的能量一定低于M的,Y的能量一定低于N的
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,计算一氧化碳在此反应条件下的转化率_____________。
CO2(g)+H2(g),在427 ℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/ L,计算一氧化碳在此反应条件下的转化率_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________移动;
(2)加入少量KSCN固体:平衡向____________移动;
(3)加入少量KCl固体:平衡____________移动,其理由是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)![]() 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。

A.加了催化剂 | B.缩小容器体积 |
C.降低温度 | D.增加SO3的物质的量 |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
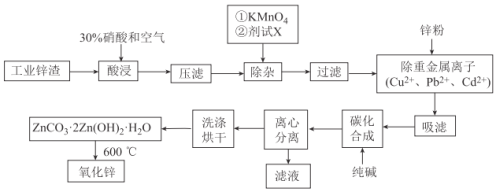
已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目: 来源: 题型:
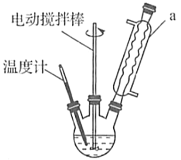
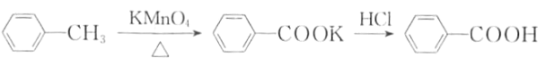
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:
名词 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在b中加入2.7mL甲苯、100mL
二、分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取m g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶中,滴加2~3滴酚酞,然后用标准浓度的KOH溶液滴定。
请回答下列问题:
(1)装置b的名称是__________________,装置a的作用为_____________________________。
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐、无色气体和黑色固体生成。加入草酸的作用是_________________________,请用离子方程式表示反应的原理______________________________。
(3)产品减压过滤时用冷水洗涤的原因是__________________________________________。
(4)选用下列__________操作,可以将粗产品进一步提纯。(选填字母)
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(5)测定纯度步骤中,判断滴定终点的标志是________________________________________________。若m=1.200g,滴定时用去0.1200mol· L-1标准KOH溶液18.00mL,则所得产品中苯甲酸的质量分数为__________(保留四位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com