
科目: 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
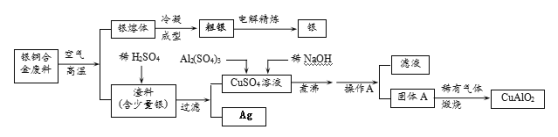
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径,反应的热化学方程式为C3H8(g)![]() C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看制备丙烯所用的丙烷可以从下面工业气体中获得的是___________。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图示。
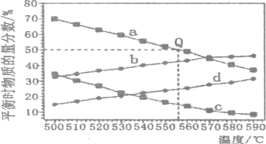
①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___________、___________。
②丙烷脱氢制丙烯反应在___________(选“高温”或低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。
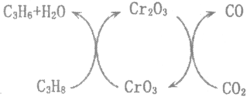
已知:CO和C3H6、C3H8的燃烧热△H分别为-283.0kJmol-1、-2049.0kJmol-1、-2217.8kJmol-1。
①298K时,该工艺总反应的热化学方程式为___________________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A. H2S+2HNO3===S↓+2NO2↑+2H2O
B. CuO+2HNO3===Cu(NO3)2+H2O
C. 4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D. 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
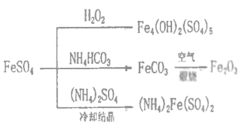
A.FeCO3转化为铁红的化学方程式:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小
C.制备Fe4(OH)2(SO4)5、Fe2O3、(NH4)2Fe(SO4)2的过程都发生了氧化还原反应
D.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目: 来源: 题型:
【题目】25°C时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A.图中a=2.6
B.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-6.4
H2CO3+OH-的Kh=1.0×10-6.4
C.M点溶液中:![]()
D.若要表示题目条件下pH与lg![]() 的变化关系.则曲线应该在平行于曲线
的变化关系.则曲线应该在平行于曲线![]() 的下方
的下方
查看答案和解析>>
科目: 来源: 题型:
【题目】复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮(PTO)与PTO-Zn2+的相互转化,原理如图所示。下列说法正确的是
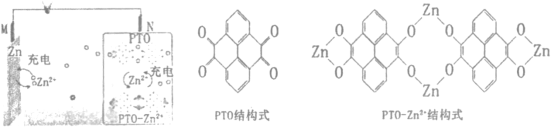
A.放电吋,N电极发生氧化反应
B.放电时,N极的电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+
C.充电时,M电极与电源负极相连
D.充电时,Zn2+向N极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和SiO2杂质。称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。(提示:SiO2杂质不与稀硫酸反应)
(1)求该样品中Fe2O3的物质的量;____。
(2)试计算样品中Al2O3的质量;____。
(3)试计算样品中Al2O3·xH2O的x值。____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com