
科目: 来源: 题型:
【题目】硫酸镍是电镀镍和化学镀镍时使用的主要镍盐。以废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍晶体的流程如图所示:
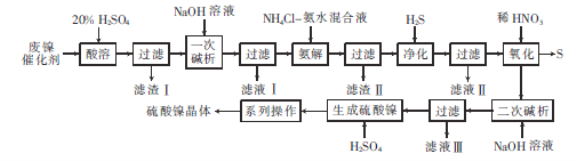
已知:Ni3+的氧化性比稀HNO3强。
回答下列问题:
(1)已知:Cr3++4OH-= CrO2-+2H2O。“一次碱析”时,需加入过量的NaOH溶液的目的是______________________。
(2)“氨解”的目的为_______________________。
(3)“净化”“过滤”后得到含有两种元素的不溶性化合物,该化合物的化学式为________,写出“氧化”中发生反应的离子方程式:____________________________________。
(4)从NiSO4溶液中得到硫酸镍晶体需经过“系列操作”为__________,__________,过滤,洗涤,干燥(填操作名称)。
(5)1844年,科学家发现金属镍可以用NaH2PO2将水溶液中的Ni2+还原出来,NaH2PO2将转化为H3PO3,这一原理现用于化学镀镍。写出化学镀镍原理的离子方程式___________。
(6)为测定硫酸镍晶体(NiSO4·n H2O)的组成,进行如下实验:称取2.63g样品,配成250.00mL溶液,准确量取配制的溶液25.00mL,用0.0400mol/L EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL。则硫酸镍晶体的化学式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
![]()
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____(填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
序号 | 实验 | 操作 | 现象 |
Ⅰ |
| 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
Ⅱ |
| 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2 在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因: __________(用离子方程式表示)。
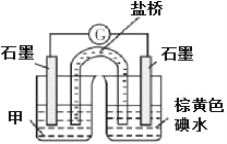
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________。
③小组同学又设计了如下实验:
序号 | 实验 | 操作 | 现象 |
Ⅳ |
| 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因 _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目: 来源: 题型:
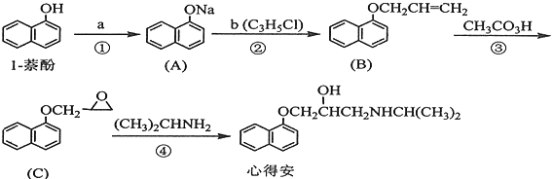
【题目】“心得安”是质料心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
(1)试剂a是____________,试剂b的结构简式为______________,b中官能团的名称是_______________。
(2)③的反应类型是____________________。
(3)心得安的分子式为_______________-。
(4)试剂b可由丙烷经三步反应合成:
![]()
反应1的试剂与条件为_______________,反应2的化学方程式为_______________,反应3的反应类型是_______________。(其他合理答案也可)
(5)芳香化合物D是1-萘(酚)的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4), E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为_______________ ;由F生成一硝化产物的化学方程式为_______________,该产物的名称是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
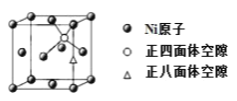
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 gcm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目: 来源: 题型:
【题目】党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2 的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4 和 HMCM-22 的表面,以 CO2 为碳源,与电解水产生的 H2 催化转化为高附加值的烃类化合物,其过程如图。
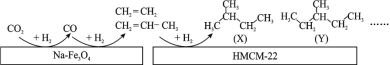
图中 CO2 转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJmol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJmol-1。图中 CO 转化为 C2H4 的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2 合成甲醇,其反应为:CO(g)+2H2(g)CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
CO | H2 | ||
1 | 0.25 | 0.50 | 0.391 |
2 | 0.25 | 1.00 | 0.781 |
3 | 0.50 | 0.50 | 0.780 |
该反应速率的通式为 v正=k正 cm(CO)cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______、n =_____(取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 molL-1时达到平衡,请计算该反应的平衡常数 K = _____。
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
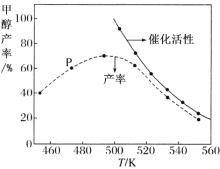
请判断温度为 470 K 时,图中 P 点 _________(填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____、 _____。
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
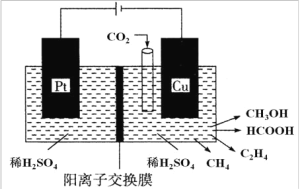
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________。
②如果Cu 电极上只生成 0.15 mol C2H4 和 0.30 mol CH3OH,则 Pt 电极上产生O2 的物质的量为 ___________mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 molL-1 HCOOH 溶液与 0.1 molL-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________(用含 a、b 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
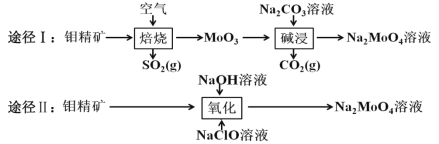
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
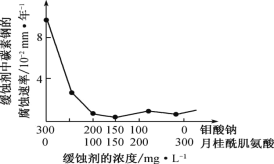
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
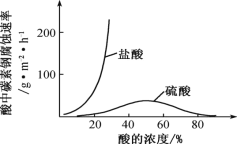
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com